
题目列表(包括答案和解析)
20.(6分)下列说法不正确的是( )
A.同一周期从左到右,元素的第一电离能逐渐增大
B.苯分子中的碳原子以sp2杂化轨道形成σ键、未杂化的2p轨道形成一个大π键
C.CO2、SO2、SO3都是非极性分子
D.Na2O2中含有非极性共价键,但Na2O2属于离子晶体,且阴阳离子的个数比为1:2
E.CsCl的晶格能大于NaCl的晶格能,所以CsCl晶体的熔点大于NaCl晶体的熔点
F.NF3分子中N原子以sp2杂化,分子呈三角形
19.(14分)工业上生产硫酸时,通过煅烧黄铁矿得SO2,利用催化氧化反应将SO2转化为SO3,SO3被吸收得硫酸。
(1)判断制硫酸的下列说法正确的是(选填字母序号) 。
a.为使铁矿充分燃烧,需将其粉碎 b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率,增大反应热。
d.沸腾炉排出的矿渣可供炼铁
(2)将SO2转化为SO3是一个关键步骤。压强及温度对SO2的转化率的影响如下表(原料气各成分的体积分数为:SO2 7% ,O2 11% ,N2 82%)
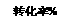
|
|

①SO2氧化成SO3的化学方程式为 ,由表中数据可知该反应为_________反应(填“放热”或“吸热”)。
②在400-5000C时,SO2的催化氧化采用常压而不是高压,主要原因是_________________
(3)为提高SO3的吸收率,减少酸雾,实际生产上用____________吸收SO3 。
(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2 吸收Br2的离子方程式是 。
(5)若以含硫40%的黄铁矿100t生产硫酸,若整个过程中硫的综合利用率为80%,则可生产98%的浓硫酸多少t?
《物质结构与性质》模块:
18.(6分)下列说法不正确的是( )
A.氯碱生产的常用方法有离子膜法、隔膜法、水银法等,其中水银法制得的碱液纯度高、质量好,所以该法是氯碱工业的最理想的方法。
B.工业合成氨时温度越高压力越大越有利。
C. 在NH3、HNO3、H2SO4的工业生产中,具有的共同点之一是都使用了催化剂
D. 硬水指的是含Ca2+、Mg2+的水
E.石油化工工业就是用物理方法把原油中的各成分进一步分离以获得石油产品的工业
F.工业电解氧化铝制铝,加入冰晶石(Na3AlF6)的主要目的是降低Al2O3的熔点。
17.(10分)某有机物B是芳香烃的含氧衍生物,其相对分子质量介于90和120之间,其中氧的质量分数约为14.8%,向该有机物中滴入FeCl3溶液不显紫色。
有机物A在一定条件下可发生下列反应:
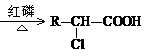
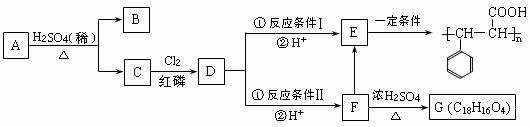
已知反应 R-CH2-COOH+Cl2 +HCl根据以上信息回答:
(1)B的结构简式为 ,B的核磁共振氢谱图上会产生 个吸收峰,且峰面积之比为 (按从大到小顺序书写)。
(2)上述反应条件Ⅰ是 。
(3)C的同分异构体中,同时符合下列要求的物质有 种。
a. 苯环上有两个侧链 b. 能发生银镜反应 c. 能发生消去反应
(4)F→E的化学方程式为 ,反应类型为 。
F→G的化学方程式为 。
[选考部分]
以下是选考题,其中第18、19题为《化学与技术》模块题,第20、21题为《物质结构与性质》模块题。考生只能从两个模块中任选一个作答,不得跨模块答题,否则只能以所答的第一个模块计分。
注意:18、20题为不定项选择题,有2个或2个以上选项符合题意,共6分,每选1个错误答案要倒扣1.5分。
《化学与技术》模块
16.(10分)利用甲烷与氯气反应制取副产品盐酸的设想在工业上已成为现实。某化学小组通过在实验室中模拟上述过程,其设计的模拟装置如下,请按要求填空:
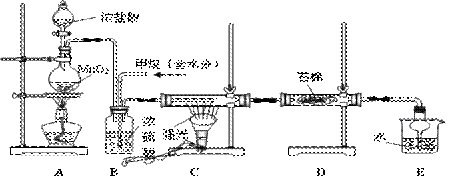
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应
(3)D装置的石棉中均匀混有KI粉末,其作用是 。
(4)下列属于E装置的作用的是 (填编号)
a.收集气体 b.吸收氯气 c.防止倒吸 d.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,
写出该反应的化学方程式 。
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 。
(7)该套装置还有缺陷,其一是没有进行尾气处理,其尾气主要成分为 (填编号)
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
除没有进行尾气处理外,整套装置还有两处明显的错误,请指出这两处错误:
15.(7分)已知某有机物的相对分子质量为58,根据下列条件,回答:
(1)若该有机物只由碳和氢两种元素组成,且分子中有一个支链,则该有机物的结构简式为______________,系统命名的名称为 该有机物的一氯取代物有 种。
(2)若该有机物为烃的含氧衍生物,且分子中有-CH3 ,无-OH和-O-,则可能的结构简式为_______________________________________________________________________
(3)若该有机物分子中无-CH3 ,又无-OH ,但能发生银镜反应,则该有机物发生银镜反应的化学方程式为_________________________________________________
14. (7分)氮是地球上含量丰富的一种元素,
(7分)氮是地球上含量丰富的一种元素,
氮及其化合物在工农业生产、生活中有着重要
作用。请回答:
(1)右图是 1 molNO2和 1 molCO反应生成CO2
和NO过程中能量变化示意图,则NO2和CO反应
的热化学方程式为:_____________ ______
(2)在一定体积的密闭容器中,进行反应: N2(g)+ 3H2(g) 2NH3(g);△H<0,
2NH3(g);△H<0,
其化学平衡常数K与温度T的关系如下表,请按要求填空:
|
T/K |
298 |
398 |
498 |
… |
|
K/(
mol·L-1)-2 |
4.1
x 106 |
K1 |
K2 |
… |
①比较K1 、K2的大小:K1 ______ K2 (填“>”、“=”或“<”)
②判断该反应达到化学平衡状态的依据是_______(填序号)
A.2 V(H2.正) = 3 V(NH3.逆) B.3molH-H键断裂的同时,有6molN-H键形成
C.容器内的压强保持不变 D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,其水解原理与NH4Cl相似,但其分两步水解。则盐酸肼第一步水解的离子方程为_________ 。
13.(10分)反应①②是两个重要的化工反应,D、E、F、G为中学化学的常见单质,D、E、G、H为气体,且E为黄绿色气体,F是常见的短周期元素形成的金属单质,G是空气主要成分之一,K是白色胶状沉淀,该沉淀能分别溶于C和H的水溶液,C的焰色反应为黄色,其物质间的转化关系如下,虚框内是需设计的内容,反应物只能用A-J中的物质:
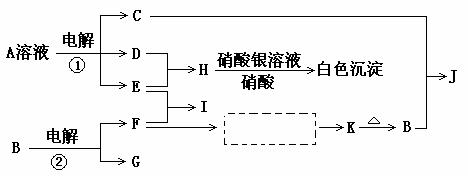
(1)A的电子式为
(2)反应①的化学方程式为
C+B→J的离子方程式为
(3)I的水溶液显 性,其溶液中的离子浓度大小关系为 。
(4)设计F→K的最佳途径如下:请在[ ]内填写F转化的中间物质的化学式

(5)按(4)的设计恰好得到1molK,至少需要另加0.75mol的H和 mol的C。
12. 甲型H1N1流感疫情已对人类健康构成威胁。目前治疗人类“甲流”的有效药物“达菲”其合成原料是我国盛产的莽草酸。其结构简式可写成
, 有关莽草酸的叙述正确的是( )
甲型H1N1流感疫情已对人类健康构成威胁。目前治疗人类“甲流”的有效药物“达菲”其合成原料是我国盛产的莽草酸。其结构简式可写成
, 有关莽草酸的叙述正确的是( )
A. 在催化剂存在下1mol莽草酸可与3molH2加成
B. 莽草酸分子式为C7H10O5
C. 莽草酸可发生加成反应、酯化反应、氧化反应、还原反应及中和反应
D. 1mol莽草酸可与4molNaOH反应
第Ⅱ卷(64分)
13-17题为必考题,是考生必答试题。18-21题为选考题,请考生根据要求做答。
11.各取下列每组混合物12 g,无论各成分质量分数是多少,完全燃烧时消耗O2相同,并总能得到17.6 g CO2的组是( )
A. 苯和乙烯 B. 乙醇和乙醚 C. 葡萄糖和甲酸甲酯 D. 乙酸和乙二酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com