
题目列表(包括答案和解析)
11.下列离子方程式正确的是
A.在稀氨水中通入过量CO2:2NH3·H2O+CO2=2 NH4++CO32-
B.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32- + 6H+ + 2MnO4- == 5SO42- + 2Mn2+ 3H2O
C.用银氨溶液检验乙醛中的醛基:
CH3CHO
+2Ag(NH3)2OH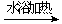 CH3COO- + NH4+
+3NH3 + 2Ag↓+ H2O
CH3COO- + NH4+
+3NH3 + 2Ag↓+ H2O
D.往苯酚钠溶液通入少量CO2:CO2
+ H2O + 2C6H5O- 2C6H5OH
+ 2CO32-
2C6H5OH
+ 2CO32-
10. 某探究小组利用丙酮的溴代反应(CH3COCH3+Br2---→CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
|
实验 序号 |
初始浓度 c/mol·L-1 |
溴颜色消失所需时间 t/s |
||
|
CH3COCH3 |
HCl |
Br2 |
||
|
① |
0.80 |
0.20 |
0.0010 |
290 |
|
② |
1.60 |
0.20 |
0.0010 |
145 |
|
③ |
0.80 |
0.40 |
0.0010 |
145 |
|
④ |
0.80 |
0.20 |
0.0020 |
580 |
分析实验数据所得出的结论不正确的是
A. 增大c(CH3COCH3),v(Br2)增大 B. 实验②和③的v(Br2)相等
C. 增大c(HCl),v(Br2)增大 D. 增大c(Br2),v(Br2)增大
9.设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是
A.标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为nA B.一定条件下,0.1mol铁与0.1mol Cl2充分反应,转移的电子数约为0.3 nA C.常温常压下,1 mol氦气含有的核外电子数为4 nA
D.标准状况下,nA个NO分子和0.5nA个O2分子混合后气体的总体积为33.6 L
|
8.下列说法正确的是
A.SiH4比CH4稳定 B.O2-半径比F-的小
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
7.下列叙述或实验不符合绿色化学理念的是( )
A.用废动植物油脂经反应改性制“生物柴油”,代替柴油作内燃机燃料
B.采用银作催化剂,用乙烯和氧气制取环氧乙烷(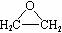 )
)
C.在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水
D.用铜和稀HNO3反应制取Cu(NO3)2
33、(16分)已知:
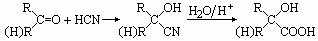 ①
①
② CH3COOCH2CH2OH的名称为乙酸羟乙酯。
软性隐形眼镜可由聚甲基丙烯酸羟乙酯(HEMA)制成超薄镜片,其合成路线如下:
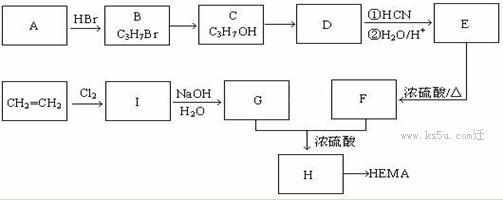 请回答下列问题:
请回答下列问题:
(1)E中含氧官能团的名称: ;
(2)写出I、E的结构简式 I 、E
(3)写出B→C、E→F反应的反应类型:B→C 、E→F 。
(4)写出A→B反应的化学方程式 ;
(5)写出满足a.能发生银镜反应;b.能与碱发生中和反应;c.分子结构中无甲基;上述三个条件的H的同分异构体的结构简式____________________
32、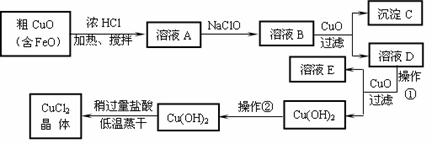 (17分)工业上制取CuCl2的生产流程如下:
(17分)工业上制取CuCl2的生产流程如下:
请结合下表数据,回答问题:
|
物 质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
 溶度积/25℃ 溶度积/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
|
完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3-4 |
(1)写出下列离子方程式:
A→B ; B→C+D 。
(2)溶液A中加入NaClO的目的是 。
(3)在溶液B中加入CuO的作用是 。
(4)操作①应控制的pH范围是: ;操作②的目的是 。
(5)由Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用“稍多量盐酸”和“低温蒸干”的目的是 。
31、(16分)环境保护和能源开发是当今社会的热门话题。根据所学化学知识解答下列问题:
⑴在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol; 2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ/mol;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ/mol
尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H = 。
请在答题纸中画出这个反应在反应过程中体系能量变化示意图,并进行必要标注:
⑵汽车尾气分析仪对CO的分析是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。
 下列说法错误的是 。
下列说法错误的是 。
A.负极的电极反应式为:CO+O2-―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
(3)某新型铝-空气燃料电池,以铝为负极,在正极通入空气,若以NaCl溶液或NaOH溶液为电解质溶液,放电时正极反应都为O2+2H2O+4e-=4OH-。那么若以NaOH溶液为电解质溶液,电池负极反应为: ;若以NaCl溶液为电解质溶液,则总反应为: 。
30、(15分)在足量的稀氯化亚铁溶液中,加入1-2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是: (填粒子的化学式,下同);乙同学认为这是发生化学反应所致,使溶液变黄色的物质是 。
(2)现提供以下试剂:
 A.酸性高锰酸钾溶液
B.氢氧化钠溶液
C.四氯化碳 D.硫氰化钾溶液.
A.酸性高锰酸钾溶液
B.氢氧化钠溶液
C.四氯化碳 D.硫氰化钾溶液.
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象。
|
同学正确 |
选用试剂(填代号) |
实验现象 |
|
第一种方法 |
|
|
|
第二种方法 |
|
|
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是 若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为是否可行? 理由是:
23.下列说法正确的是
A.根据Ksp(AgCl)=1.77×10-10mol2·L-2,Ksp(Ag2CrO4)=1.12×10-12mol3·L-3,可以推知AgCl的溶解度比Ag2CrO4的溶解度大
B.0.1mol·L-1的ZnCl2溶液中通入足量硫化氢气体最终得不到ZnS沉淀是因为溶液中
c(Zn2+)·c(S2-)<Ksp(ZnS)
C.AgCl在10mL 0.01mol·L-1的KCl溶液中比在20mL0.05mol·L-1的AgNO3溶液中溶解的质量大
D.向碳酸钡沉淀中加入稀硫酸,沉淀发生转化,可推知硫酸钡的Ksp比碳酸钡的小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com