
题目列表(包括答案和解析)
3、 在一定条件下,体积为2L的定容的密闭容器中,充入3mol A和1mol B两种气体,发生反应:2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol/L,则下列判断错误的是:
在一定条件下,体积为2L的定容的密闭容器中,充入3mol A和1mol B两种气体,发生反应:2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol/L,则下列判断错误的是:
A、x=1 B、2min内A的反应速率为0.3mol/(L•min)
C、B的转化率为40% D、若混合气体密度不变表明该反应达到平衡状态
2、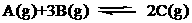 在一定温度下,下列叙述不是可逆反应:达到平衡的标志的是:
在一定温度下,下列叙述不是可逆反应:达到平衡的标志的是:
① C的生成速率等于C的分解速率② 单位时间生成a mo lA,同时生成3a mol B
③ A、B、C的浓度不再变化时④容器内的压强保持恒定⑤ A、B起始物质的量之比为1:3,当A与B物质的量之比保持1:3时⑥ A、B、C的分子数之比为1:3:2
A、②③⑤ B、①③④ C、②⑤⑥ D、②④⑥
1、在某温度下,反应:在密闭容器中达到平衡,下列判断正确的是:
A、温度不变,增大体积,ClF3的产率提高 B、温度不变,缩小体积,ClF的转化率增大
C、升温,增大体积,有利于平衡正向移动 D、降温,体积不变,F2的转化率降低
33.(17分)
A、B、C、D、E、F和G都是有机化合物,它们的关系如下图所示:

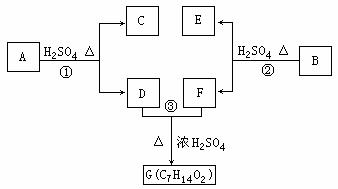
(1)化合物C的分子式是C7H8O,C遇到FeCl3溶液显示紫色,C与溴水反应生成的一溴代物只有一种,则C的结构简式为 。
(2)D为一直链(不带支链)化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D分子式为 ,D具有的官能团名称是 。
(3)反应①的化学方程式是 。
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是 。
(5)E可能的结构简式是 。
31.(13分)重铬酸钠(Na2Cr2O7)广泛用于合成颜料、媒染剂等,以铬铁矿(主要成分为Cr2O3,还有FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程图如下:
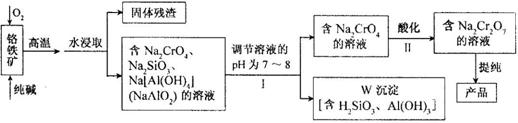
请回答下列问题。
⑴铬铁矿中的Cr2O3与纯碱、O2在高温下反应的化学方程式为 。
(2)若Ⅰ中只用一种试剂调节溶液的pH,应选用 (填标号)。
A.稀硫酸 B.氧化钠固体 C.氢氧化钾溶液
(3)Ⅰ中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因
是 。(用离子方程式表示)。
(4)Ⅱ中,Na2CrO4转化为Na2Cr2O7的离子反应如下:
2CrO42-(黄色)+2H+ Cr2O72-(橙红色)+H2O
Cr2O72-(橙红色)+H2O
①该反应 (填“是”或“不是”)氧化还原反应。
②若往Na2Cr2O7溶液(橙红色)中加入足量NaOH固体,溶液 (填标号)。
A.变黄色 B.颜色不变 C.橙红色变深
③已知:25℃,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7。25℃,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是 。
30.(16分)过氧化氢是重要的氧化剂、还原剂,其水溶液又称双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定过氧化氢的含量,并探究过氧化氢的性质、用途。
Ⅰ.测定过氧化氢的含量
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250mL 容量瓶中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下:2MnO4-+5H2O2+6H+=2Mn2++8H2O+ 5O2↑,重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为________________________。
(3)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
(4)该化学兴趣小组根据所提供的实验条件设计了两个实验,分别验证过氧化氢的氧化性和不稳定性。(实验试剂只有:过氧化氢溶液、稀硫酸、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)请填写他们的实验方法和实验现象的表中空白:
|
实验内容 |
实验方法 |
实验现象 |
|
验证氧化性 |
取适量碘化钾淀粉溶液、稀硫酸于试管中,滴入过氧化氢溶液。(或:取适量饱和硫化氢溶液于试管中,滴入过氧化氢溶液。) |
。 (或: ) |
 验证热不稳定性 验证热不稳定性 |
取适量过氧化氢溶液于试管中,
。 |
产生气泡,带火星的木条复燃。 |
Ⅲ.用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜
(5)印刷电路板金属粉末中的Cu在H2SO4与H2O2溶液中反应生成Cu2+和H2O的离子方程式为 。
(6)控制其他条件相同,印刷电路板的Cu用10℅H2O2和3.0 mol/L H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率如下表:
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率 ( 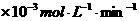 ) ) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是
。
23.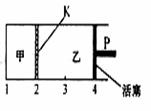 一定温度下可逆反应:A(s)+2B(g)
一定温度下可逆反应:A(s)+2B(g) C(g)+D(g) △H<0。 现将1mol A和2molB加入甲容器中,将2 molC和2 mol
D加入乙容器中,此时控制活塞P,使甲的容积为1L,乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
C(g)+D(g) △H<0。 现将1mol A和2molB加入甲容器中,将2 molC和2 mol
D加入乙容器中,此时控制活塞P,使甲的容积为1L,乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
A.保持温度和活塞位置不变,向甲中再加入1 mol A和2mol B, 达到新的平衡后,
c(B)甲=2c(B)乙
B.保持温度和乙中体积不变 ,向乙中加入2 mol D,达到新平衡后,c(B) 乙≤2c(B) 甲
C.若该温度下反应的K=1,则甲中B和乙中C的转化率均为66.7%
D.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大
22.下列有关溶液中微粒浓度的关系正确的是
A.碳酸氢钠溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
B.浓度均为0.1mol/L的 CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-) +2c(OH-) = c(CH3COOH)+2c(H+)
C.0.1mol/L NaHSO3溶液(pH<7)中:
c(Na+)>c(HSO3一) >c(H2SO3) >c(SO32-) >c(H+)>c(OH-)
D.新制氯水中:c(Cl2) > c(H+)> c(Cl-) >c(ClO-) >c(HClO) > c(OH-)
12.根据下列实验内容得出的结论正确的是
|
选项 |
实 验 内 容 |
结 论 |
|
A |
某物质的水溶液使红色石蕊试纸变蓝 |
该物质一定是碱 |
|
B |
某气体能使湿润淀粉碘化钾试纸变蓝 |
该气体一定是氯气 |
|
C |
某物质的水溶液中加入盐酸产生无色无味气体 |
该溶液一定含有碳酸根离子 |
|
D |
往铁和稀硝酸反应后的溶液中滴入KSCN溶液,溶液显血红色 |
反应后溶液中肯定有Fe3+,可能还有Fe2+ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com