
题目列表(包括答案和解析)
11. 室温下,下列各项中的比值为2 : 1的是
A.0.2mol/L醋酸溶液与 0.1mol/L醋酸溶液中c(H+)之比
B.(NH4)2SO4溶液中c(NH4+)和c(SO42-)的物质的量浓度之比
C.pH= 2的盐酸和pH=12的Ba(OH)2溶液中溶质的物质的量浓度之比
D.0.2 mol/LCH3COONa溶液与 0.1mol/L Na2CO3溶液中c(CH3COO-)与c(CO32-)之比
10.下列离子方程式书写正确的是
A.用含氢氧化铝的胃舒平治疗胃酸过多:OH- + H+ = H2O
B.向AgCl的悬浊液中加入KI溶液:AgCl(s) + I-  AgI(s) + Cl-
AgI(s) + Cl-
C.苯酚钠溶液与二氧化碳反应: 2C6H5O-+ CO2 + H2O = 2C6H5OH + CO32-
D.稀硝酸与过量的铁屑反应: Fe + 4H+ + NO3- = Fe3+ + NO↑ + 2 H2O
9. 右表是元素周期表主族元素的一部分,已知短周期元素A最外层电子数是次外层的三倍。下列关于这四种元素说法正确的是
A.气态氢化物的稳定性:A<D
B.原子半径:B<C<A<D
C.A与B组成的两种化合物均只由离子键构成
D.B、C、D三种元素的最高价氧化物对应水化物间可两两反应
8.下列说法正确的是
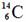 A. 0.1 mol 原子中含中子数为0.8×6.02×1023
A. 0.1 mol 原子中含中子数为0.8×6.02×1023
B. 0.5 mol/L CuCl2溶液中含有的Cu2+数为0.5×6.02×1023
C. 1 mol CO和 CO2混合物中,含有的碳原子数为2×6.02×1023
D. 2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.1×6.02×1023
|
|
|
|
|
|
A |
|
B |
|
C |
|
|
D |
7.下列关于分类的说法正确的是
A.置换反应都属于离子反应
B.煤的干馏、煤的液化都属于物理变化
C.Fe(OH)3胶体和CuSO4溶液都是混合物
D.冰醋酸、纯碱、小苏打分别属于酸、碱、盐
6. 下列说法中正确的是
A.水晶、陶瓷、玻璃的主要成分都是硅酸盐
B.油脂的皂化、淀粉制葡萄糖均属于水解反应
C.凡含有食品添加剂的食品均对人体有害,不可食用
D.大量使用煤、石油、天然气等化石燃料,可降碳减排,防止温室效应
19.(12 分)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)基态溴原子的电子排布式为 ▲ 。
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近。Cl2、BrI、ICl沸点由高到低的顺序为 ▲ 。
(3)多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为 ▲ 。
(4)I3+属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为 ▲ 。
(5)气态氟化氢中存在二聚分子(HF)2,这是由于 ▲ 。
(6)①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]的酸性由强到弱的顺序为 ▲ (填序号)。
南通市通州区2010届高三查漏补缺专项练习
18.(10分)合成氨是人类科学技术发展史上的一项重大突破,目前工业上用氢气和氮气直接合成氨,制得的氨通过催化氧化可生产硝酸。
在一定条件下,若N2和H2以体积比1:3的比例充入一体积不变的密闭容器中反应,达到平衡状态时,测得混合气体中氨的体积分数为20.0%,则:
(1)合成氨反应达到平衡的标志 ▲ 。
A.容器内气体压强保持不变
B.容器内各物质的浓度不随时间变化
C.当υ(H2,正)=0.3mol·L-1·min-1,υ(NH3,逆)=0.2mol·L-1·min-1时
D.1个N≡N键断裂的同时,有3个H-H键形成
(2)达到平衡时,N2和H2的转化率分别为 ▲ 。
(3)用氨催化氧化可生产硝酸,取所生产的硝酸溶液100mL,与足量的铜反应,生成的NO2和NO混合气体在标准状况下体积为6.72L,物质的量之比为2:1,求所生产硝酸的物质的量浓度?(请写出该小题的计算过程)
▲ 。
(4)某厂用NH3生产硝酸,然后再制硝酸铵,其过程如下:

其中反应②为:4NO+3O2+2H2O 4HNO3,原料气为氨气和空气的混合物。
4HNO3,原料气为氨气和空气的混合物。
若实际生产中,反应①、②、③的转化率(或利用率)分别为a、b、c,则生产硝酸的氨气占所用氨气总量的体积分数为 ▲ 。
17.(12 分)某芳香烃的分子式为C12H14,其苯环上的一氯代物只有一种,A能发生如下图所示的转化,并最终制得合成纤维J和合成橡胶K。(某些反应条件已略去)
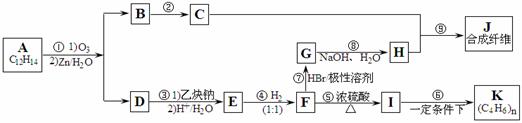
已知:

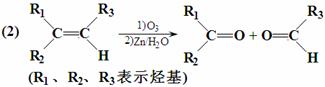

Ⅰ.请回答下列问题:
(1) A的结构简式 ▲ 。
(2)上述转化发生的反应中,属于消去反应的是 ▲ 。
(3)反应⑨的化学方程式是 ▲ 。
(4)请写出两种符合下列条件的B的同分异构体的结构简式:
①能与FeCl3溶液反应显色;②能与溴的CCl4溶液发生加成反应;③苯环上有三个取代基。
▲ 、 ▲ 。
Ⅱ.3-戊醇可作香料。以甲醛和乙炔钠为原料,其他试剂自选,完成其合成路线。
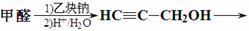 ▲ 。
▲ 。
16.(10 分)SO2和NOx的排放是造成酸雨的两大罪魁祸首。下图表示了某地区在1940~2002年间,空气中SO2和NOx含量因燃料燃烧、工业生产、交通运输以及其他因素的影响而发生变化的基本统计数据。
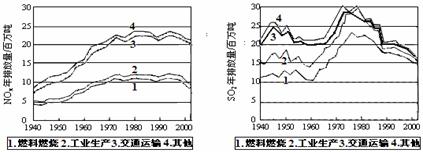
(1)结合上图数据,判断下列说法正确的是 ▲ 。
A.在交通运输中排放的NOx与燃料的不充分燃烧有关
B.在上世纪60年代以前,在交通运输中排放的SO2主要是使用燃煤的内燃机所致
C.近年来在工业生产中SO2排放量的下降,主要是减少了燃烧的煤的质量
D.随着汽车工业的发展,在形成酸雨的因素中,NOx所占比重在逐渐增大
(2)在上图表示的历史进程中,由工业生产所导致的SO2的排放量明显地在逐年减少。请用化学方程式说明人类在为解决SO2污染问题中所进行的一个反应过程:
▲ 。
(3)汽车排放的尾气中含有未燃烧充分的CmHn、以及N2、CO2、NO、CO等。有人设计利用反应2NO +
2CO  N2 + 2CO2 将有害的污染物转化为可参与大气循环的N2和CO2。
N2 + 2CO2 将有害的污染物转化为可参与大气循环的N2和CO2。
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
|
时间/h |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/mol·L-1 |
1.00×10-3 |
4.5×10-4 |
2.5×10-4 |
1.5×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO)/mol·L-1 |
3.6×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |



 在上述条件下反应能够自发进行,则反应的
在上述条件下反应能够自发进行,则反应的 ▲ 0(“>”、“<”、“=”)。
▲ 0(“>”、“<”、“=”)。 在该温度下,反应的平衡常数K= ▲ 。
在该温度下,反应的平衡常数K= ▲ 。
(4)某次降雨过程收集到10L的雨水,向雨水中滴加1mL6mol/L的H2O2,充分反应后测得溶液的pH=3.62 [c(H+) =2.4×10-4 mol/L ]),再向溶液中加入足量的Ba(OH)2溶液,经过滤、晾干、称重,得沉淀的质量为0.1864g。若假设雨水的酸性仅由NOx和SO2的排放所致。请计算排放在空气中的NOx和SO2的物质的量之比接近于 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com