
题目列表(包括答案和解析)
13.(10分)(1) 已知H-H键、N-H键、N≡N键的键能分别是436kJ/mol、391kJ/mol、946kJ/mol,请据此计算合成反应氨反应的的△H
(2)在温度为T1时,将1molN2和3molH2混合于容积为10L密闭容器中.

①反应达到A平衡,若混合气体中氨的物质的量分数为25%,则N2的转化率为
②当温度由T1到T2是平衡常数KA KB(填< >或=)
(3)若在温度为T1时,向10L密闭容器中加入N2 0.5mol;H21.5mol; NH31mol,当容器中反应达平衡时,物质的量增加的物质是 。
12.(10分)常温下,将某一元酸HX和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HX物质的量 浓度(mol·L-1) |
NaOH物质的量 浓度(mol·L-1) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
C1 |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
C2 |
C2 |
pH=10 |
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,
若a 7(填>、<或=),则HX为强酸;
若a 7(填>、<或=),则HX为弱酸。
(2)在乙组混合溶液中离子浓度 (X-)与
(X-)与 (Na+)的大小关系是
。
(Na+)的大小关系是
。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HX是 酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的
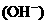 =
mol·L-1。
=
mol·L-1。
11.(13分)某同学想通过下图装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物。

Ⅰ.装置D的作用 。
Ⅱ.如何检验反应中是否有O2生成 。
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
(1)装置C中,假设2的反应方程式为 。
(2)乙同针对以上两个假设,提出了两个实验方案
方案①在Na2O2反应完全后,为进行如下图实验:

得出结论:产物是Na2SO4。
该方案是否合理 (填“是”或“否”),理由是 。
方案②在反应进行一段时间后,取少量C中固体放入BaCl2溶液中,充分反应后再加入足量稀盐酸,如果溶液中出现白色沉淀,可得出结论,产物是Na2SO4,假设2成立此方案是否合理(填”是”或”否” 理由是
。
9. 以Pt为电极,电解含有0.10molCu2+和0.10molM2+的溶液(M表示金属),阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)的关系如图所示。则离子的氧化能力由大到小的排列正确的是 ( )
以Pt为电极,电解含有0.10molCu2+和0.10molM2+的溶液(M表示金属),阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)的关系如图所示。则离子的氧化能力由大到小的排列正确的是 ( )
A.Cu2+>M2+ >H+
B.Cu2+> H+>M2+
C.M2+> H+>Cu2+
D.H+>M2+ > Cu2+
10.某无色气体X,可能含有CO2、SO2、HCl、HBr中的一种或几种。将X通过适量的氯水时,X恰好完全反应, 没有任何气体剩余。将所得的无色溶液分装于两支试管后, 分别加入酸化的AgNO3 与BaCl2溶液,结果均产生白色沉淀。下列推论正确的是( )
A.X中可能有CO2 B.X中一定有SO2
C.X中一定没有HBr D.X中可能有HCl
第Ⅱ卷 非选择题 (共70分)
用钢笔直接答在答题纸上,不能答在试题中.
8.下列反应最终无沉淀产生的是 ( )
A.过量的CO2通入Na2SiO3溶液中 B.向硫化钠溶液中滴加氯水溶液
C.少量的CO2通入澄清石灰水中 D.向AlCl3溶液中滴加氨水至过量
7.已知KHSO3溶液呈弱酸性。在0.1mol·L-1KHSO3溶液中,下列关系正确的是( )
A.c(K+ )+c(H+ )=c(HSO3-)+c(OH-)+c(SO32-)
B.c(HSO3-)+c(SO32-)=0.1 mol·L-1
C.c(SO32-)<c(H2SO3)
D.c(K +)=c(H2SO3)+c(HSO3-)+c(SO32-)
6.下列离子方程式正确的是 ( )
A.过氧化钠和水反应:2O2-2+2H2O=4OH-+O2↑
B.亚硫酸氢铵和氢氧化钠的反应:NH4++OH-=NH3↑+H2O
C.向次氯酸钠溶液中通入少量SO2:ClO-+SO2+H2O=Cl-+SO42-+2H+
D.向氯花铜中加入少量氨水: Cu2++2OH-=Cu(OH)2↓
5.下述实验设计能够达到目的的是 ( )
|
编号 |
实验目的 |
实验设计 |
|
A |
除去CO2中少量的SO2 |
将混合气体通过饱和Na2 CO3溶液 |
|
B |
除去.Cu粉中混有的CuO |
向混合物中滴加适量稀硝酸,再过滤 |
|
C |
检验溶液中是否含有Fe2+ |
向溶液中滴入氯水后,再加KSCN溶液 |
|
D |
证明H2CO3酸性比H2SiO3强 |
将CO2通人Na2SiO3溶液中 |
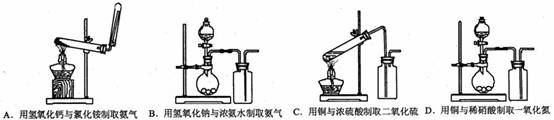
4.下列气体制备装置错误的是 ( )
2.钢铁在潮湿的空气中会形成原电池而被腐蚀,下列说法正确的是 ( )
A.原电池的正极反应为:O2 + 2H2O + 4e-=4OH-
B.原电池的负极反应为:Fe-3e-=Fe3+
C.钢铁设备上连接铜块可以防止腐蚀
D.钢铁与外加直流电源的正极相连可以防止腐蚀
3.酸化”是实验中经常采用的方法,下列酸化过程正确的是 ( )
A.提高高锰酸钾的氧化能力-----用盐酸酸化
B.抑制Fe2+的水解-----用稀硝酸酸化
C.确认溶液中含有Ag+时,先加硝酸酸化,再加Cl-检验
D.确认溶液中含有SO42-时,用盐酸酸化,再加Ba2+检验
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com