
题目列表(包括答案和解析)
11. 室温下,下列各项中的比值为2 : 1的是
A.0.2mol/L醋酸溶液与 0.1mol/L醋酸溶液中c(H+)之比
B.(NH4)2SO4溶液中c(NH4+)和c(SO42-)的物质的量浓度之比
C.pH= 2的盐酸和pH=12的Ba(OH)2溶液中溶质的物质的量浓度之比
D.0.2 mol/LCH3COONa溶液与 0.1mol/L Na2CO3溶液中c(CH3COO-)与c(CO32-)之比
10.下列离子方程式书写正确的是
A.用含氢氧化铝的胃舒平治疗胃酸过多:OH- + H+ = H2O
B.向AgCl的悬浊液中加入KI溶液:AgCl(s) + I-  AgI(s) + Cl-
AgI(s) + Cl-
C.苯酚钠溶液与二氧化碳反应: 2C6H5O-+ CO2 + H2O = 2C6H5OH + CO32-
D.稀硝酸与过量的铁屑反应: Fe + 4H+ + NO3- = Fe3+ + NO↑ + 2 H2O
9. 右表是元素周期表主族元素的一部分,已知短周期元素A最外层电子数是次外层的三倍。下列关于这四种元素说法正确的是
A.气态氢化物的稳定性:A<D
B.原子半径:B<C<A<D
C.A与B组成的两种化合物均只由离子键构成
D.B、C、D三种元素的最高价氧化物对应水化物间可两两反应
8.下列说法正确的是
 A. 0.1
mol 原子中含中子数为0.8×6.02×1023
A. 0.1
mol 原子中含中子数为0.8×6.02×1023
B. 0.5 mol/L CuCl2溶液中含有的Cu2+数为0.5×6.02×1023
C. 1 mol CO和 CO2混合物中,含有的碳原子数为2×6.02×1023
D. 2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.1×6.02×1023
|
|
|
|
|
|
A |
|
B |
|
C |
|
|
D |
7.下列关于分类的说法正确的是
A.置换反应都属于离子反应
B.煤的干馏、煤的液化都属于物理变化
C.Fe(OH)3胶体和CuSO4溶液都是混合物
D.冰醋酸、纯碱、小苏打分别属于酸、碱、盐
6. 下列说法中正确的是
A.水晶、陶瓷、玻璃的主要成分都是硅酸盐
B.油脂的皂化、淀粉制葡萄糖均属于水解反应
C.凡含有食品添加剂的食品均对人体有害,不可食用
D.大量使用煤、石油、天然气等化石燃料,可降碳减排,防止温室效应
16.(10分)有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。已知:

①B分子中没有支链。
②D能与碳酸氢钠溶液反应放出二氧化碳。
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl取代,其一氯代物只有一种。
④F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应有 (选填序号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应
(2)D、F分子所含的官能团的名称依次是 、 。
(3)写出与D、E具有相同官能团的同分异构体的可能结构简式: 。
(4)E可用于生产氨苄青霉素等。已知E的制备方法不同于其常见的同系物,据报道,可由2-甲基-1-丙醇和甲酸在一定条件下制取E。该反应的化学方程式是 。
16、(10分)A B C三种短周期元素,原子序数依次增大,A是原子半径最小的元素;B原子的最外层电子层中,未成对电子数等于已成对电子数;C原子最外电子层中,已成对电子数目等于该元素所在周期的序数,p能级中没有空轨道,其电子只有一种自选状态,请回答:
(1)请对比由A 、B两种元素的原子组成的直线形分子(甲),和由A、B、C三中元素原子组成的直线形分子(乙)
①两分子中数目相同的化学键是 键。
②分别由甲乙组成的物质中,在水中溶解度较大的是 ,判断的依据是 。
(2)请对比由A 、B两形成的简单分子(丙),和由A 、C两形成的简单分子(丁)
①两分子的空间结构都呈立体结构的原因是:中心原子都 。
②分别由丙丁组成的物质中,熔点高的是 。判断依据是 。
[有机化学基础]
15.(14分)科学家们提出用工业废弃中CO2制取甲醇CO2+3H2 CH3OH+H2O,其流程如下所示:
CH3OH+H2O,其流程如下所示:

(1)分解池中反应的化学方程式为 。
(2)在合成塔中若有4.4gCO2与足量氢气完全反应,生成气态水和甲醇,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式:
该反应的熵变△S 0(填< >或=)
(3)在体积为2 L的密闭容器中(体积不变),充入1mol CO2和2.5mol H2在图示条件下测得CO2和CH3OH(g)的物质的量随时间变化如图所示。

①从反应开始到平衡,平均反应速率v(CO)=
②反应的平衡常数K=
③下列措施能使,n(CH3OH)/n(CO2)增大的是
A.升高温度B,加入催化剂
C.将H2O(g)从体系中分离出来
D.再充入1mol CO2和3mol H2
E.将容器改为恒温恒压容器
(4)已知

则CH3OH的燃烧热△H=
选做题
(只能从一下两个模块任选一个)
[物质结构与性质]
14.(13分)耐火材料主要成分为MgO和A1 O
O ,某厂用蛭石(主要成份为:MgO、Fe2O3、A12O3、SiO2)作原料生产耐火材料。化学课外小组同学用蛭石进行了以下实验:
,某厂用蛭石(主要成份为:MgO、Fe2O3、A12O3、SiO2)作原料生产耐火材料。化学课外小组同学用蛭石进行了以下实验:
Ⅰ.查阅资料得知0.1mol/L的离子浓度时,氢氧化物沉淀时的pH为
|
氢氧化物 |
Fe(OH)3 |
Mg(OH)2 |
AI(OH)3 |
|
|
开始沉淀时的pH |
2.3 |
10.4 |
4.0 |
开始溶解:7.8 |
|
完全沉淀时的pH |
3.7 |
12.4 |
5.2 |
完全溶解:10.8 |
Ⅱ.实验流程如下(固体A、F为一种成份):
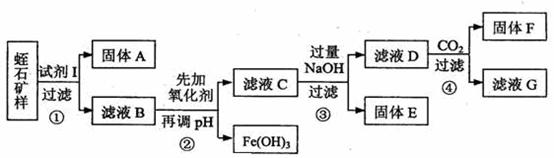
请回答以下问题:
(1)写出下列物质化学式:试剂I___________________;固体F 。
(2)步骤②可把pH调节到 。下列氧化剂中最好选用 (填字母)
A.KMnO4 B.H2O2 C.NaClO D.浓HNO3
(3)步骤③中C生成D的离子反应方程式为 ,要保证固体D杂质尽量少,步聚②调节溶液的pH合理范围是 :
A.5.7~2.8 B.7.8~12.4
C.小于7.8 D.大于12.4
(4)步骤④中反应的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com