
题目列表(包括答案和解析)
6、在大型演唱晚会上,观众经常使用荧光棒来增添喜庆气氛。荧光棒内草酸二苯酯和过氧化氢反应导致发光的原理大致如下:①草酸二苯酯+H2O2-→C2O4+2C6H5OH;②生成的中间产物把能量传递给染料:C2O4+染料-→染料*(电子激发态)+2CO2,电子激发态的染料不稳定,借发光而回到基态。下列说法不正确的是
A. 草酸二苯酯的分子式是C14H10O4 B. 上述变化证明化学能可以转化为光能
C.
C2O4的结构简式是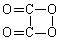 D. 反应①属于酯水解反应
D. 反应①属于酯水解反应
28.(14分)(1)△H=-890.3KJ/mol (2分)
(2)O2 + 4e_ + 2H2O = 4OH- (2分)
(3)2Cl-
+ 2H2O  H2↑ + Cl2↑ + 2OH-(2分)
H2↑ + Cl2↑ + 2OH-(2分)
13 (2分)
(4)① 0.16 mol•(L•min) -1(1分) ② 0.17 (2分)
③ 放 (1分) ④ b=2a (2分)
27.(16分)(1)2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+2H2O (2分)
(2)①轻轻挤压滴管,使少量水加入烧瓶,然后打开止水夹K。(2分)
②NH3 + H2O 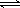 NH3·H2O
NH3·H2O
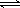 NH4+ + OH- (2分)
NH4+ + OH- (2分)

 (3)① 3CuO + 2NH3
3Cu + N2 + 3H2O (2分)
(3)① 3CuO + 2NH3
3Cu + N2 + 3H2O (2分)
② 吸收氨气中混有的水蒸气,防止干扰产物水的测定。(2分)
③ 此装置无有尾气吸收装置,NH3排入大气,污染环境;
连接一个吸收氨气装置如图所示:(合理即给分)。(2分)
(4)取少许样品,加入稀H2SO4,若溶液出现蓝色,说明红色
物质中含有Cu2O反之则没有 (2分)
(5)7 :3
26.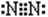 (13分)(1)第二周期 第ⅣA族 (2分)
(2分)
(13分)(1)第二周期 第ⅣA族 (2分)
(2分)
(2)生成白色絮状沉淀迅速变成灰绿色,最后变成红褐色。(2分)
(3) < (1分) ,NH4+ + H2O 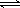 NH3·H2O
+ H+ (2分)
NH3·H2O
+ H+ (2分)
(4)10-10 :1 (2分)
 (5)CH2Cl2、CHCl3、CCl4
(2分)
(5)CH2Cl2、CHCl3、CCl4
(2分)
25.(15分)(1)a c (每个1分,共2分)
 (2)
(2)
(三个写任写2个即可,
每空2分,共4分)
(3)① 羟基、羧基(每空1分,共2分)
② 取代反应 (1分)
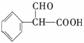
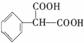
 ③
③
+ 2 Cu(OH)2 + Cu2O↓+ 2H2O(2分)

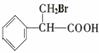
④ + NaOH + NaBr + H2O
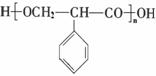
⑤
28.(14分)近年来,碳和碳的化合物在生产生活实际中应用广泛。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知 ① 2 CH4 (g) + 3O2 (g) = 2 CO (g) + 4 H2O(l) △H1 = -1214.6 KJ/mol
② 2 CO (g) + O2(g) = 2 CO2 (g) ΔH2 = -566 kJ/mol
则反应CH4(g) + 2 O2 (g) = CO2 (g) + 2 H2O (l) 的△H = 。
(2)将两个石墨电极插人KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极,其电极反应式是:CH4 + 10 OH―― 8e-= CO32-+ 7 H2O;通入O2的一极,其电极反应式是 。
(3)若用石墨做电极电解500 ml饱和食盐水,写出电解反应的离子方程式为: ;电解一段时间后两极共收集到标准状况下的气体1.12 L(不考虑气体的溶解)。停止通电,假设反应前后溶液体积不变,则所得溶液的pH= 。
 (4)将不同量的CO (g) 和H2O
(g) 分别通入到体积为2 L的恒容密闭容器中,进行反应
(4)将不同量的CO (g) 和H2O
(g) 分别通入到体积为2 L的恒容密闭容器中,进行反应
CO (g) + H2O (g) CO2 (g) + H2 (g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
|
H2O |
CO |
CO2 |
CO |
|||
|
1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
① 实验1中以υ(H2) 表示的反应速率为 。
② 实验2中的平衡常数是 (计算结果保留两位小数)。
③ 该反应的正反应为 (填“吸”或“放”)热反应。
④ 若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),
则a、b应满足的关系是 (用含a、b的数学式表示)。
27.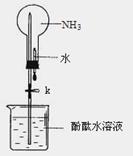 (16分)氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。请回答:
(16分)氨是一种重要的化工原料,某学习小组欲制取氨气并探究其性质。请回答:
(1)实验室制取氨气的化学方程式是 。
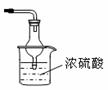
(2)①右图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是 。
②氨气使烧杯中溶液由无色变为红色,其原因是_______________________________(用电离方程式表示)。
(3)该小组同学设计了下图所示的实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。

① 实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式 。
② 碱石灰的作用是 。
③该装置存在明显缺陷,请指出存在的问题并提出改进意见
。
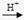 (4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+ Cu + Cu2+)。
(4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+ Cu + Cu2+)。
请你设计一个简单的实验检验该红色物质中是否含有Cu2O。
;
(5)工业废气中的氮氧化物是主要的大气污染物之一。为了治理污染,工业上常用氨气与之发生反应:NOx+NH3→N2+H2O,使其转化为无毒的N2 。现有NO2和NO的混合气体3.0 L,跟3.4 L(同温同压下)NH3反应,恰好使其全部转化为氮气,则原混合气体中,NO2与NO的体积比是__________。
26.(13分)A、B、C、D、E为短周期元素,其原子序数依次增大。其中,A元素原子半径最小;B元素原子的电子总数与最外层电子数之比为3 :2;C元素最高价氧化物对应水化物与其氢化物反应生成一种盐甲。A、E同主族,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。请回答:
(1)写出B元素在周期表中的位置 , C单质的电子式是____________。
(2)A、D、E组成的化合物乙与氯化亚铁溶液反应的实验现象为 。
(3)常温下,甲的水溶液pH_______7(填>、<或=),其原因是(用离子方程式表示)_____________________。
 (4)乙和B、D、E组成的化合物丙,它们的水溶液pH均为12时,两溶液中由水电离出的c(OH-),乙 :丙=
。
(4)乙和B、D、E组成的化合物丙,它们的水溶液pH均为12时,两溶液中由水电离出的c(OH-),乙 :丙=
。
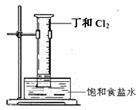
(5)A和B组成化合物丁,其相对分子质量为16。将右图装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状液滴生成等现象。油状液滴的成分可能是(写分子式) 。
25.(15分)乙基香兰素是当今世界上最重要的合成香料之一,其结构简式如下图所示。
 (1)以下推测正确的是 (填字母)。
(1)以下推测正确的是 (填字母)。
a.该物质能发生银镜反应
b.从分子结构上看,它应该属于芳香烃
c.1 mol该物质最多能与4 mol H2发生加成反应
d.该物质的一个分子内含有一个碳氧双键、三个碳碳双键
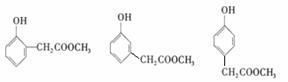
(2)乙基香兰素的同分异构体X,其分子中苯环上有2个取代基。X可以发生水解反应生成M和N两种有机物。M可与饱和溴水反应生成白色沉淀。N的质谱图显示相对分子质量为32,红外光谱图上发现有O-H键、C-H键和C-O键的振动吸收。写出2种符合上述要求的X的结构简式 ; 。
(3)乙基香兰素的另一种同分异构体Y,分子中苯环上只有1个取代基,它可以和碳酸氢钠反应生成CO2。

① Y分子中含氧官能团的名称是 。
② 由Y→B的反应属于_______________(填反应类型)。
③ A与新制Cu(OH)2反应的化学方程式是 。
④ 由B生成C的化学方程式是 。
⑤ Y发生缩聚反应所得产物的结构简式是 。
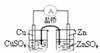
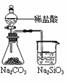
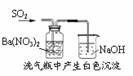
12.下列实验对应的结论正确的是
|
实验 |
 |
 |
 |
 |
|
结论 |
能组成 Zn、Cu原电池 |
能证明非金属性 Cl>C>Si |
白色沉淀 为BaSO3 |
说明反应 2NO2  N2O4
△H>0 N2O4
△H>0(无色) |
|
选项 |
A |
B |
C |
D |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com