
题目列表(包括答案和解析)
11. 在一含Na+的澄清溶液中,可能还存在NH4+、Fe2+、I-、Br-、CO32-、SO32-六种离子中的几种。①在原溶液中滴加足量的饱和氯水后,有气泡生成,溶液呈黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不能使淀粉溶液变蓝色。根据上述实验事实推断,下列说法不正确的是 ( )
A. 溶液中一定存在Br-、CO32- B. 溶液中可能存在NH4+
C. 溶液中一定不存在Fe2+、I-、SO32- D. 溶液一定呈碱性
10. 实验室可用右图装置(启普发生器)制取氢气。欲使得到氢气的速率加快,下列措施可行的是 ( )
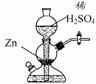 A.将稀硫酸改用浓硫酸
A.将稀硫酸改用浓硫酸
B.向稀硫酸中加入少量浓H2SO4
C.向稀硫酸中加入Cu(NO3)2溶液
D.给装置中发生反应的部分加热
9. 设NA为阿伏加德罗常数,下列叙述中正确的是 ( )
A.35.5g超氧化钾(KO2)所含的阴离子中电子数为8NA
B.17g氨气所含电子数目为8B NA
C.常温常压下,92gNO2和N2O4混合气体中含有的原子数为6NA
D.工业上铜的电解精炼时电解池中每转移1mol电子时阳极上溶解的铜原子数为0.5 NA
8. 甲、乙两种物质的溶解度曲线如下图所示:下列说法一定正确的是( )
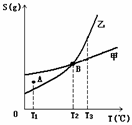 A. A点表示T1℃时甲的溶液已饱和,乙的溶液未饱和
A. A点表示T1℃时甲的溶液已饱和,乙的溶液未饱和
B. B点表示T2℃时甲、乙两物质的溶液均达饱和且两溶液的物质的量浓度相等
C. 将T3℃时甲、乙两物质的饱和溶液分别降温至T2℃,析出的乙 比析出的甲多
D. 若乙中含有少量的甲,可用重结晶的方法提纯乙
7. 达菲(Tamiflu)被认为是目前世界上公认的能够治疗人禽流感病的唯一有效的药物,它是由我国特有中药材八角的提取物--莽草酸(shikimicacid)为原料合成的。已知莽草酸和达菲的结构式如下:( )
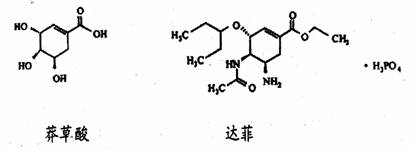
下列判断正确的是 ( )
A.它们互为同系物
B.莽草酸能使溴的四氯化碳溶液褪色,达菲不能
C.达菲在热的NaOH溶液中能稳定存在
D.莽草酸的分子式为C7H10O5
6. 化学是以实验为基础的自然科学,化学实验设计和操作中必须十分重视师生安全问题和环境保护问题。下列实验问题处理方法正确的是 ( )
A.制氧气时排水法收集氧气后出现倒吸现象,应立即停止加热
B.在气体发生装置上直接点燃乙炔气体时,不需先检验乙炔气体的纯度
C.白磷在空气中易自燃,用剩的白磷可溶解于CS2后倒入垃圾箱
D.给试管中的液体加热时,可加入碎瓷片或不时移动试管,以免暴沸伤人
28.将绿矾(FeSO4.7H2O)隔绝空气条件下强热分解,已知产物全部为氧化物,为探究绿矾分解的反应产物,某同学进行了以下实验:
实验一:为探究固体产物中Fe元素的价态,该同学将固体产物溶于足量的稀H2SO4得到相应溶液,进行以下猜想和实验
|
猜想 |
实验操作 |
预期现象 |
|
猜想一:Fe元素只显______价 |
①向所得溶液中滴入KSCN溶液 ②向稀酸性KMnO4溶液中滴入所得溶液 |
KSCN溶液无明显现象 |
|
猜想二;Fe元素只显______价 |
稀酸性KMnO4溶液颜色_____ |
|
|
猜想三:Fe元素既有+2价又有+3价 |
KSCN溶液呈______色 稀酸性KMnO4溶液颜色______ |
实验二:为进一步探究该反应的产物,进行了如下图所示的实验
①实验开始时,点燃B处酒精喷灯之前应先打开A处活塞通CO2,其目的是
。
②装置图中C的作用是 。
③该组同学称取了55.6克绿矾按如图装置进行试验,待绿矾分解完全后,测得D瓶中沉淀的质量为23.3克,根据这些数据,可以得知,绿矾分解的化学方程式为_____________
④该组同学设计的装置存在着一个明显的缺陷是
27. 合成氨工业的部分工艺流程如下图所示:
合成氨工业的部分工艺流程如下图所示:
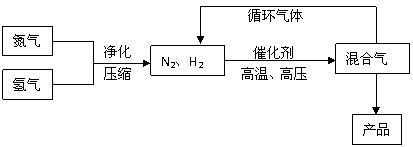






 请你回答下列问题:
请你回答下列问题:
 (1)已知:N2(g)+O2(g)
=2NO(g);△H=180.5kJ·mol-1
(1)已知:N2(g)+O2(g)
=2NO(g);△H=180.5kJ·mol-1
 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=–905kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=–905kJ·mol-1
 2H2(g)+O2(g)=2H2O(g)
;△H=–483.6kJ·mol-1
2H2(g)+O2(g)=2H2O(g)
;△H=–483.6kJ·mol-1
 则N2(g)+3H2(g)
则N2(g)+3H2(g) 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。
 (2)改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是_________
(2)改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是_________ 。
。
A.增大压强 B.降低温度 C.使用催化剂 D. 增大反应物的浓度 

(3)在一定条件下,将2molN2与5molH2混合于一个10L的密闭容器中,反应情况如右图所示: 图
①求5min内的平均反应速率v(NH3)=_______________
②达到平衡时NH3的体积分数为___________%
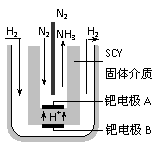 (4)近年来科学家提出了电解合成氨的方法:采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了高转化率的电解法合成氨(装置如右图)
(4)近年来科学家提出了电解合成氨的方法:采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了高转化率的电解法合成氨(装置如右图)
请回答:钯电极A是电解池的_______极(填“阳”或“阴”),该极上的电极反应式是_________________________
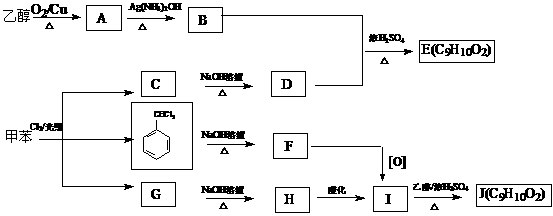
26.甲苯是有机化工生产的基本原料之一。利用乙醇和甲苯为原料,可按下列路线合成分子式均为C9H10O2的有机化工产品E和J。
 已知:
已知: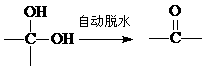
(1)甲苯 C的反应类型为________;
C的反应类型为________;
(2)F的结构简式为____________;
(3)写出下列反应方程式
①B+D→E______________________________________________________
②G→H ______________________________________________________
(4)E、J有多种同分异构体,写出符合下列条件的同分异构体结构简式(任写两种)
①与E、J属同类物质②苯环上有两个取代基且苯环上的一氯代物只有两种。
_______________________________________________
25.A~E是原子序数依次增大的五种短周期元素,其性质或结构信息如下表所示
|
元素 |
A |
B |
C |
D |
E |
|
结构或性质信息 |
单质是空气中主要成分之一,其氢化物水溶液呈碱性 |
原子核外有两个未成对电子 |
日常生活中常见的金属,通常用电解法冶炼其单质 |
其简单阴离子带两个单位负电荷 |
单质有毒,常温下为有色气体,常用于自来水消毒 |
请结合表中信息完成下列各题:
(1)C在元素周期表中的位置是 ,
D的简单阴离子的核外电子排布式为 。
(2)下图是A~E的第一电离能和电负性数据,请回答
①图中序列5是元素 (用元素符号回答) 图
②下列各组元素最有可能形成离子化合物的是 (填编号)
a.A、B b.A、E c.B、C d.C、E
(3)A的常见单质分子中有多个共价键。
①常温下,该单质化学性质很稳定,是因为
②该单质分子中δ键与π键的数目之比为 。
(4)写出C、E形成的化合物与A的氢化物在水溶液中反应的离子方程式
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com