
题目列表(包括答案和解析)
30.某化学兴趣小组探究氯化铁溶液的某些性质,将一定量氯化铁固体先加入含1molHCl的浓盐酸中,再加水配制成1L溶液A。
(1)若在A溶液中加入一块铜片,一段时间后得溶液B。写出铜片在FeCl3溶液中反应的离子方程式: ;
(2)若在B中加铁粉m g,充分反应后剩余固体n g;过滤,从1L滤液中取出20 mL,向其中滴入40 mL 2 mol/L AgNO3溶液时,Cl- 恰好完全沉淀。则溶液A中FeCl3的物质的量浓度是______________;
(3)若在A溶液中加铁粉至不再溶解,则需铁粉_______________克。
29.芳香化合物A、B互为同分异构体,B的结构简式如下:
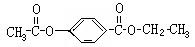
 A经①、②两步反应得C、D和E。B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如图所示。
A经①、②两步反应得C、D和E。B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如图所示。
(1)写出E的结构简式: ;
(2)A有2种可能的结构,写出相应的结构简式 ;
(3)F和小粒金属钠反应的化学方程式是 ,
实验现象: ;
(4)写出F在浓H2SO4作用下在170℃发生反应的化学方程式: ,
实验现象: ,反应类型: ;
(5)写出F与H在加热和浓H2SO4催化作用下发生反应的化学方程式: ,
实验现象: ,反应类型: ;
(6)在B、C、D、F、G、I化合物中,互为同系物的是 。
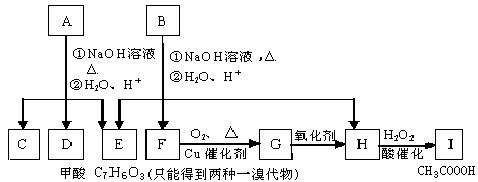
28.科学家发现某药物M能治疗心血管疾病是因为它在人体内能释放出一种“信使分子”D,并阐明了D在人体内的作用原理。请回答下列问题:
(1)已知M的相对分子质量为227,由C、H、O、N四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%。则M的分子式是________。D是双原子分子,分子量为30,则D的分子式为________。
(2)油脂A经下列途径可得到M。图中②的提示:
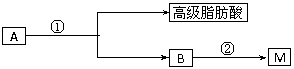
②的反应类型________________________;
(3)C是B和乙酸在一定条件下反应生成的化合物,分子量为134,写出C所有可能的结构简式____________________________;
(4)若将0.1mol B与足量的金属钠反应,则需消耗_________g金属钠。
27.某厂用蛭石(主要成份为:MgO、Fe2O3、A12O3、SiO2)作原料生产A12O3与Fe(OH)3。
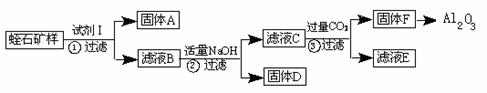 Ⅰ.工艺流程如下(只有固体A和F为纯净物):
Ⅰ.工艺流程如下(只有固体A和F为纯净物):
Ⅱ.查阅资料:某些阳离子浓度为0.1mol/L时,氢氧化物沉淀时的pH为:
|
氢氧化物 |
Fe(OH)3 |
Mg(OH)2 |
Al(OH)3 |
|
开始沉淀时的pH |
2.3 |
10.4 |
4.0 |
|
完全沉淀时的pH |
3.7 |
12.4 |
5.2 |
注:Al(OH)3 pH=7.8时开始溶解,10.8时完全溶解。
请回答以下问题:
(1)写出下列物质化学式:试剂I______________,F ;
(2)步骤②B生成C的离子方程式: ;
(3)要使固体D杂质尽量少,步聚②调节溶液的pH合理的是 ;
A.12.4~13 B.10.8 C.3.7~5.2
(4)滤液E中存在较多的阴离子是_____________,滤液E中加入过量的NaOH溶液,充分沉淀后,检验上层清液中金属阳离子的操作步骤是________________________;
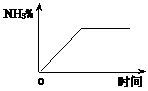 (5)固体D可用来生产合成氨的表面催化剂。右图表示无催化剂时,某合成氨的NH
(5)固体D可用来生产合成氨的表面催化剂。右图表示无催化剂时,某合成氨的NH 的百分含量随时间变化曲线,请在图上用虚线画出该反应有催化剂时的曲线。
的百分含量随时间变化曲线,请在图上用虚线画出该反应有催化剂时的曲线。
26.现有一瓶已久置的Na2SO3固体,为了研究其组成,同学们进行了如下探究:
可选用试剂:浓H2SO4、浓HNO3、10%盐酸、0.1mol/LH2SO4、0.1mol/L HNO3、0.1mol/LBaCl2、0.1mol/LBa(NO3)2、3%H2O2、10%NaOH溶液、蒸馏水、品红溶液;
仪器自选。
(1)提出假设
假设一:固体全部是Na2SO3;
假设二:固体全部是Na2SO4;
假设三: ;
(2)设计实验方案(略);
(3)同学们经充分讨论后选择D装置进行实验:原因是:_____________________;
(4)请完成下表:
|
实验步骤 |
预期现象和结论 |
|
步骤1:取适量固体样品于微型试管中;在W管a处滴入 、b处滴入10%NaOH溶液;用胶管将W管与微型试管连接好。 |
|
|
步骤2:用针筒吸入10%盐酸,将针头穿过微型试管的胶塞,向固体注入过量的盐酸。 |
若无气泡放出、且品红不褪色,则: : 若 ,则假设一或假设三成立。 |
|
步骤3:拨出针筒,吸入蒸馏水洗净;再吸入适量0.1mol/LBaCl2溶液注入________中。 |
若假设一成立,则试管中产生无白色沉淀,a处品红溶液褪色。 若假设二成立,则__________________。 若假设三成立,则__________________。 |
25.
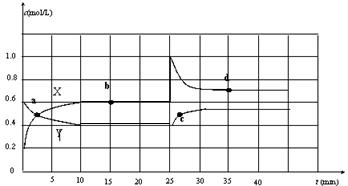 现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如图。已知:2NO2(g) N2O4(g)+Q。
现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭容器中,反应物浓度随时间变化关系如图。已知:2NO2(g) N2O4(g)+Q。
(1)前10min内用NO2表示的化学反应速率v(NO2)= ;
(2)a、b、c、d四个点中,表示化学反应处于平衡状态是 ;
 (3)35min时,反应2NO2(g) N2O4(g)在d点的平衡常数K(d) K(b)(填“>”、“=”或“<”)
(3)35min时,反应2NO2(g) N2O4(g)在d点的平衡常数K(d) K(b)(填“>”、“=”或“<”)
(4)若要达到使NO2(g)的百分含量与d点相同的化学平衡状态,在25min时还可以采取的措施是 。
A.加入催化剂 B.缩小容器体积 C.升高温度 D.加入一定量的N2O4
24.异氰酸(HNCO,碳元素呈+4价)。可用于消除氮氧化物(以NO2计)对环境的污染。
某一反应体系共有HNCO、NO2、N2、CO2和H2O五种物质。
(1)在消除NO2的反应中,发生氧化反应的过程是 → ;
 (2)将氧化剂与还原剂及配平好的系数填入下列空格中,并标出电子转移的方向和数目:
(2)将氧化剂与还原剂及配平好的系数填入下列空格中,并标出电子转移的方向和数目:
(3)按上述反应式进行反应,计算吸收4.6kg气体,消耗异氰酸的质量为 kg(保留二位小数);
(4)在相同条件下,消除等体积NO和NO2,NO所需异氰酸的质量少,其原因是 。
23.四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
单质为银白色固体、导电性强。其在空气中燃烧生成淡黄色固体。 |
+3价阳离子的核外电子排布与氖原子相同。 |
单质常温、常压下是气体,原子的L层有一个未成对的p电子。 |
原子核外s电子数等于p电子数。它存在同素异形体。 |
(1)B元素在周期表中的位置 ,写出A原子的电子排布式 ;
(2)写出A与D形成化合物的电子式 ;
A与D形成的化合物溶于水后,溶液的pH 7(填“大于”、“等于”或“小于”)。
(3)写出C单质与水反应的化学方程式: ;
(4)A、B两元素金属性较强的是(写元素符号) ,写出证明这一结论的一个实验事实 ;
22.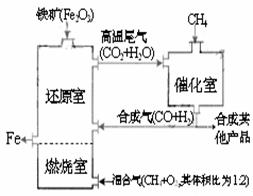 竖炉炼铁工艺流程如图,使天然气发生部
竖炉炼铁工艺流程如图,使天然气发生部
分氧化,并在燃烧室中使氧气和天然气燃
烧:CH4(g)+2O2(g)→CO2(g)+2H2O(g) +Q
催化反应室发生的反应为:
CH4(g)+H2O(g)
 CO(g)+3H2(g)-216kJ
CO(g)+3H2(g)-216kJ
CH4(g)+
CO2(g)  2CO(g) + 2H2(g) -260kJ
2CO(g) + 2H2(g) -260kJ
(不考虑其他平衡的存在),下列说法正确的是
A.增大催化反应室的压强,甲烷的转化率增大
B.催化室需维持在550-750℃,一能提高CH4转化的速率,二能增大反应速率
C.此工艺流程中原料,一是铁矿石,二是甲烷
D.设计燃烧室目的,一是产生CO2和水蒸气,二是提供还原室所需的热量
第II卷 (共84分)
21.向铁铜的混合物中,加入一定量硝酸,溶液中存在的金属离子是
A.只有Fe2+ B.只有Fe2+ 和Fe3+ C.只有Cu2+ 和Fe3+ D.只有Cu2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com