
题目列表(包括答案和解析)
29、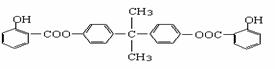 利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,已知G不能发生银镜反应,BAD结构简式为:
利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,已知G不能发生银镜反应,BAD结构简式为:
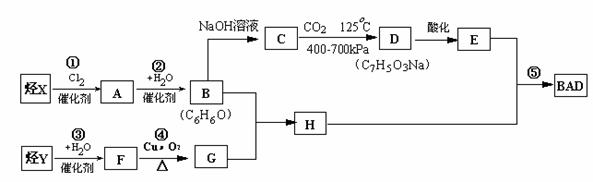
BAD的合成路线如下:
试回答下列空白:
(1)写出结构简式Y D 。
(2)属于取代反应的有 (填数字序号)
(3)BAD的一氯代物最多可能有 种。
(4)写出反应的化学方程式:反应④
B+G→H 。
28、石油裂解气的主要产物乙烯,在不同条件下氧化能生成不同的产物:
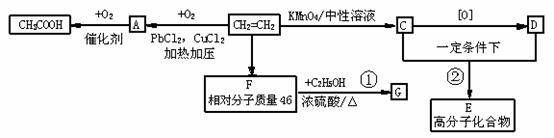
已知:C分子中含两个碳原子,1mol C与足量的金属钠反应,放出22.4LH2(标准状态);
A、F均能发生银镜反应。
(1)写出A中官能团的名称________________。
(2)写出反应类型:② 。
(3)写出结构简式:E 。
(4)写出与G属于同类有机物的同分异构体的结构简式 。
(5)写出化学方程式:反应① ;
(二)称取质量为1.96g的莫尔盐制成溶液。用未知浓度的酸性KMnO4溶液进行滴定。
(1)已知MnO4-被还原为Mn2+,试写出该滴定反应的离子方程式__________________。
(2)判断该反应到达滴定终点的现象为 。
(3)假设到达滴定终点时,用去V mL 酸性KMnO4溶液,则该酸性KMnO4溶液的浓度为_______mol/L。
(一)实验室制取少量莫尔盐的流程如下:
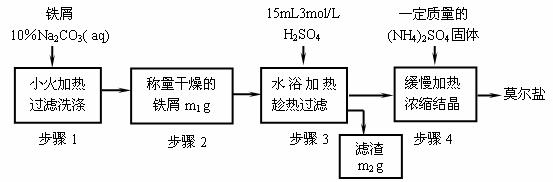
试回答下列问题:
(1)步骤1中加入10%Na2CO3溶液的主要作用是 ;反应中铁屑过量是为了___________________________________。
(2)步骤3需要趁热过滤,原因是______________________________________。
(3)从步骤4到莫尔盐,必须进行的操作依次是____________________________,析出的晶体常用________洗涤。
(4)若莫尔盐的饱和溶液中有水20克,当温度从30℃降至10℃,最多析出莫尔盐的质量是________(选填编号)。
A.2.18g B. 大于2.18g C.小于 2.18g D.无法确定
26.已知某重金属化合物能催化H2O2的分解。下图是氨的催化氧化的实验装置,试管中加入适量浓氨水并滴入1ml 2%AgNO3(aq),溶液仍然澄清,B为胶头滴管,吸有25%的H2O2(aq),A是气球,C中装有铂石棉催化剂。点燃酒精灯一段时间后,将B中的H2O2溶液慢慢地滴入试管,试管中逸出大量气体使气球鼓起。回答下列问题:
(1)得到的澄清溶液名称为________________,试管中逸出的气体是 。
(2)C中发生化学反应后,就可以停止加热,原因是: 。
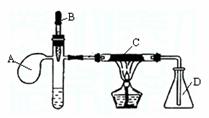 (3)D中的现象是
。
(3)D中的现象是
。
(4)A的作用是 。
(5)本实验还可以改用其他药品,例如在试管中加
,胶头滴管预先吸入 。(写物质名称)
(6)此实验装置的缺点是 。
27.硫酸亚铁铵的化学式为(NH4)2SO4•FeSO4•6H2O,商品名为莫尔盐,可由硫酸亚铁与硫酸铵反应生成。一般硫酸亚铁盐在空气中易被氧化,而形成莫尔盐后就比较稳定了。三种盐的溶解度(单位为g/100g水)如下表:
|
温度/℃ |
10 |
20 |
30 |
|
(NH4)2SO4 |
73.0 |
75.4 |
78.0 |
|
FeSO4·7H2O |
20.0 |
26.5 |
32.9 |
|
(NH4)2SO4•FeSO4 |
17.2 |
21.6 |
28.1 |
25. 反应① Fe(s)+CO2(g) FeO(s)+CO(g)
+akJ;
反应① Fe(s)+CO2(g) FeO(s)+CO(g)
+akJ;
 反应② CO(g)+1/2O2(g) CO2(g)
+bkJ
反应② CO(g)+1/2O2(g) CO2(g)
+bkJ
测得在不同温度下,反应①的平衡常数K值随温度的变化如下:
|
温度/℃ |
500 |
700 |
900 |
|
K |
1.00 |
1.47 |
2.40 |
(1)反应①的化学平衡常数表达式为 ,a 0(填“大于”、“小于”或“等于”)。 在500℃2L密闭容器中进行反应①,CO2起始量为4mol,其转化率为50%,则CO的平衡浓度为 。
(2)700℃反应①达到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有
(填序号)。
A.缩小反应器体积 B.通入CO2 C.升高温度到900℃ D.使用合适的催化剂
(3)下列图像符合反应①的是
(填序号)(图中v是速率、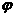 为混合物中CO含量,T为温度且T1>T2)
为混合物中CO含量,T为温度且T1>T2) 。
。
 (4)由反应①和②可求得,反应2Fe(s)+O2(g) 2FeO(s)+Q 的Q=
。
(4)由反应①和②可求得,反应2Fe(s)+O2(g) 2FeO(s)+Q 的Q=
。
24.下面是元素周期表的前三周期。请用相应的化学用语回答下列问题:
|
a |
|
|
|
|
|
|
|
|
b |
|
|
c |
d |
e |
f |
|
|
g |
|
h |
|
|
|
|
|
(1)写出由e形成的两种阴离子的符号,它们带有相同的电荷数:____________、____________;
(2)h的单质能与g元素的最高价氧化物对应水化物的溶液反应,请写出该反应的化学方程式____________________________________
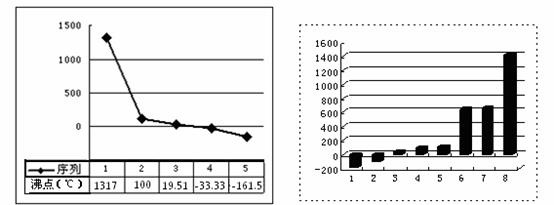
(注:序列与b、c、d、e、f 并不一一对应)
(3)上左图表示的是b、c、d、e、f的氢化物的沸点(℃)。序列 “5”的氢化物是由______键构成的______分子(均填写“极性”或“非极性”)。由c和 e 组成的可灭火的物质的电子式是____________ 。
(4)上右图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则柱形“8”熔点最高的原因是_____________________ 。
23.某反应体系如下:
(1)请配平该离子方程式,并标出电子转移的方向和数目。
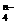 ____Fe(OH)3 + ____ClO- + ____OH- --____FeO + ____Cl-+ ____H2O
____Fe(OH)3 + ____ClO- + ____OH- --____FeO + ____Cl-+ ____H2O
完成配平后回答下列问题:
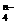 (2)已知有3.21 g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=_______,FeO
(2)已知有3.21 g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=_______,FeO
中铁元素为为__________价。
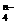 (3)根据(1)和(2)推测FeO 能与下列哪些物质反应(填序号)_________。
(3)根据(1)和(2)推测FeO 能与下列哪些物质反应(填序号)_________。
A、Cl2 B、SO2 C、H2S D、O2
22.将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共0.8mol,这些气体恰好能被500mL2mol/LNaOH溶液完全吸收,溶液中生成NaNO3和 NaNO2,则原混合气体中NO的物质的量为
A.0.3mol B. 0.4mol C.0.5mol D. 0.6mol
第Ⅱ卷
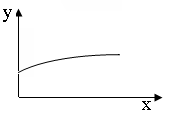
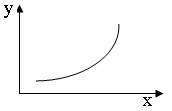
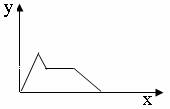
21.下列坐标图所表示的量的关系正确的是 B
|
|

|
|||
|
|||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com