
题目列表(包括答案和解析)
15.(8分)
某溶液中可能含有SO32-、SO42-、 HCO3- 三种离子中的两种或三种。为探究其组成,小明取出两份相同的样品溶液于试管中,向一份中加入过量的盐酸,产生无色气泡;向另一份中滴加过量的氯化钡溶液,产生白色沉淀。请设计合理实验,做进一步的探究,对小明的实验给出结论。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、集气瓶、铁架台、漏斗、滤纸、酒精灯、带单孔胶塞的导管;lmol/L硫酸;2mol/L盐酸;2mol/L硝酸、;lmol/L氯化钡、澄清石灰水、品红溶液、蒸馏水。
完成下列探究过程:
(1)提出假设:
假设l:溶液中存在SO32-、SO42- 假设2: ;
假设3: ;假设4:溶液中存在SO32-、SO42-、 HCO3-
(2)基于假设4 , 设计出实验方案,将实验操作、预期的实验现象和结论填在下表中。
[提示] I、在答题卡上按照下表的方式作答,注意前后内容的对应。
Ⅱ、注意文字简洁,超出答题卡空间视为无效。
III 、可不填满,也可增加步骤。
|
步骤编号 |
实验操作 |
预期现象和结论 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
|
…… |
…… |
…… |
14.(11分)
现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高。
⑴ 已知:1 mol N2(g)与适量H2(g)完全反应,生成NH3(g),放出92.2 kJ热量,写出反应的热化学方程式: 。
⑵若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1 K2(填“>” “=” 或 “<” )。
⑶在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为 ,用氮气表示的反应速率为: 。若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:
(任意写一条)。
⑷在上述相同条件下,若起始时加入4 mol NH3、2 mol H2及固体催化剂,反应达到平衡时NH3的体积分数比(3)中 (填“大”、“小”或“相等”)。
⑸氨被氧化生成一氧化氮的化学方程式为: 。
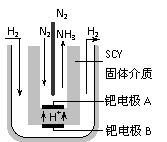 ⑹随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如右图)。
⑹随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如右图)。
请回答:在电解法合成氨的电解池中 (填“能”或“不能”) 用水作电解质溶液的溶剂,原因是 。
钯电极A是电解池的 极(填“阳”或“阴”),该极上的电极反应式是 。
13.(9分)
铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。有关含铬化合物的相互转化关系如下
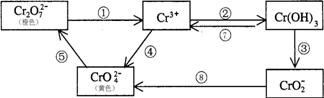
回答下列问题:
(1)上述反应中需用氧化剂的是 (填编号)。
(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应和溶液中进行的反应的离子方程式:阳 极 阴 极
溶液中
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式 。
(4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是 。
(5)要将Fe3+溶液中的杂质离子Cr3+除去,可加入过量NaOH溶液,过滤后再用酸溶解。写出有关的离子方程式 。
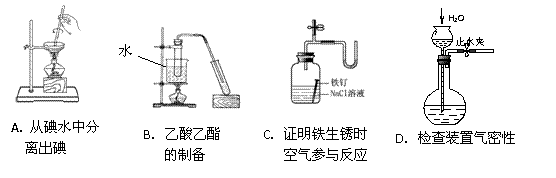
12.下列装置或操作能达到实验目的的是 ( )
第Ⅱ卷
本卷包括必考题和选考题两部分。第13题-第17题为必考题,每个试题考生都必须做答。第18题-第20题为选考题,考生根据要求做答。
11.下列离子方程式正确的是 ( )
A.硫酸铝溶液中加过量氨水:Al3++4OH-→AlO2-+2H2O
B.向苯酚钠溶液中通入少量的二氧化碳:CO2+H2O+C6H5O-→C6H5OH+HCO-3
C.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:
Ba2++2OH-+NH+4+H++SO2-4→BaSO4↓+NH3·H2O+H2O
D.过量铁粉与一定量稀硝酸反应:Fe+4H++NO-3→Fe3++NO↑+2H2O
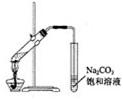
10. 下列有关实验操作的叙述正确的是
A.实验室常用右图所示的装置制取少量的乙酸乙酯
B.用50mL酸式滴定管可准确量取25.00mLKMnO4溶液
C.用量筒取5.00mL 1.00mol·L-1盐酸于50mL容量瓶中,
加水稀释至刻度,可配制0.100 mol·L-1盐酸
D.用苯萃取溴水中的溴,分液时有机层从分液漏斗的上口倒出
9. . 化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的杀菌净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
 C.MgO的熔点很高,可用于制作耐高温材料
C.MgO的熔点很高,可用于制作耐高温材料
D.电解MgCl2饱和溶液,可制得金属镁
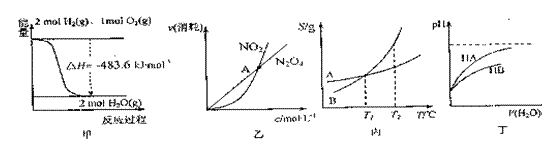 7.下列关于图4的各项叙述正确的是:
7.下列关于图4的各项叙述正确的是:
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ·mol-1
 B.乙表示恒温恒容条件下发生的可逆反应2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中A点对应的状态为化学平衡状态
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中A点对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数仍为B=A
D.丁表示常温下,稀释HA、HB两种酸的浓溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
8.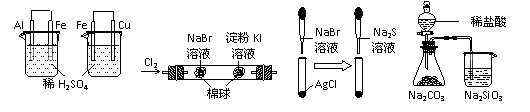 根据下列实验现象,所得结论正确的是:
根据下列实验现象,所得结论正确的是:
A B C D
|
实
验 |
实验现象 |
结 论 |
|
A |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
|
B |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
|
C |
白色固体先变为淡黄色,后变为黑色 |
溶解性 :AgCl>AgBr>Ag2S |
|
D |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:Cl>C>Si |
6.下列叙述正确的是:
A.将二氧化硫气体通入浅黄色的溴水中使其颜色褪去,说明二氧化硫具有漂白性
B. SiO2为碳族元素的非金属氧化物为酸性氧化物,故不能与任何酸发生化学反应
C.用砂纸打磨过的铝箔放在酒精灯焰上不燃烧,说明铝不易与O2反应
D.向装有NaHCO3溶液的两支试管中各滴入CaCl2和MgCl2的饱和溶液,后者有沉淀呈现
5.短周期元素A、B、C原子序数依次递增,它们的原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数。下列叙述正确的是:
A.原子半径A<B<C B.A的氢化物的稳定性小于C的氢化物
C.B的氧化物的熔点比A的氧化物高 D.A与C可形成离子化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com