
题目列表(包括答案和解析)
9、根据下列实验现象,所得结论正确的是( )
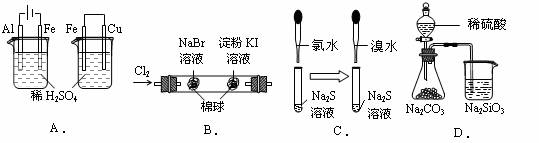
|
实验 |
实验现象 |
结论 |
|
A. |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
|
B. |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性:Cl2>Br2>I2 |
|
C. |
左边溶液产生黄色沉淀,右边溶液产生黄色沉淀 |
氧化性:Cl2>Br2>S |
|
D. |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:S>C>Si |
8.下列说法正确的是
A.由于H2O分子间存在氢键,所以H2O比H2S稳定。
B.11.2 L O2和CO2的混合气体中含有6.02×1023个氧原子。
C.固态NaCl不导电,是由于NaCl晶体中不存在阴、阳离子。
D.可逆反应达平衡状态后,化学反应速率发生变化,平衡不一定移动。
7、下列叙述中正确的是( )
A.某非金属元素从游离态变成化合态时,该元素一定被还原
B.气态氢化物的稳定性:HF>HCl,是因为H-F的键能大于H-Cl
C.NF3分子的结构是三角锥形,分子中三个N-F键的性质完全相同,故NF3分子是非极性分子
D.分子晶体在状态变化或溶于水的过程中,均不会破坏化学键
6、A.金属腐蚀就是金属原子失去电子被还原的过程
B.将金属a与外加直流电源的正极相连,而将负极接到废铁上,可防止金属a被腐蚀
C.钢铁电化学腐蚀时,负极反应式为:2H2O+O2+4e=4OH-
D.氯碱工业中,阳极发生的反应为:2Cl--2e=Cl2↑
6、下列说法正确的是( )
20. 化学与技术(20分)
(I)多项选择题(6分
下列实验操作中不正确的是……( ) A.向稀氨水中逐滴加入AgNO3溶液来制取银氨溶液; B.做石油分馏实验时,温度计浸入液面以下; C.切割金属钠时,必须用镊子夹取,用滤纸吸干,置于桌面上的玻璃片上,小心用小刀切割; D.洁净的试管里加入0.5g淀粉,再加入4mL质量分数为20%的H2SO4,加热3--4分钟,再放入银氨溶液,水浴加热以检验水解产物。 E. 制备Fe(OH)2操作中的胶头滴管下端必须插入液面下
(II)(14分)
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备K2FeO4的常用方法有两种。
方法Ⅰ:次氯酸盐氧化法。工艺流程如图13.


(1) 完成“氧化”过程中反应的化学方程式:

 FeCl3+ NaOH+
→
Na2FeO4+ +
FeCl3+ NaOH+
→
Na2FeO4+ +
其中氧化剂是 (填化学式)。
(2)“转化”过程中发生反应的化学方程式为 。
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶发提纯,操作是:将粗产品用
溶解,然后 。
方法Ⅱ:电解法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH。
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为 。
19. [化学-有机化学基础](20分)
(I)多项选择题(6分
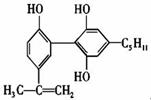 举办“人文奥运”的一个重要体现就是禁止运动员服用兴奋剂。有一种兴奋剂的结构简式如右图,下列有关该物质的说法不正确的是( )
举办“人文奥运”的一个重要体现就是禁止运动员服用兴奋剂。有一种兴奋剂的结构简式如右图,下列有关该物质的说法不正确的是( )
A.该分子中所有碳原子一定处于同一平面中
B.1mol该物质与足量浓溴水反应时,至少消耗4molBr2
C.该物质属于酚类物质,遇到FeCl3:溶液有可能发生显色反应
D.该物质能使酸性KMnO4溶液褪色,即可证明其分子必存在碳碳双键
E. 1mol该物质与足量与足量的金属钠反应能生成3molH2
(II)(14分)
丁香酚、香兰素、乙酸香兰素都是重要的香料和食品添加剂,它们的结构简式如下:
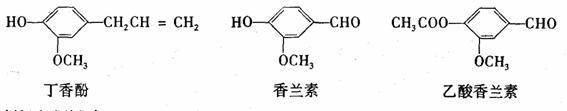

请填写下列空白。
(1)丁香酚是合成香兰素的原料,鉴别丁香酚和香兰素可选用的试剂是 。
(2)丁香酚在一定条件下发生加聚反应,该反应产物的结构简式为 。
(3)乙酸香兰素在酸性条件下发生水解反应的化学方程式为 。
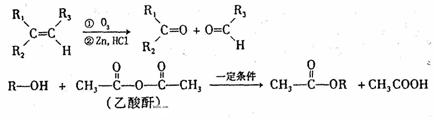 (4)已知:
(4)已知:
以丁香酚为原料合成香兰醇二乙酸酯的流程如下:
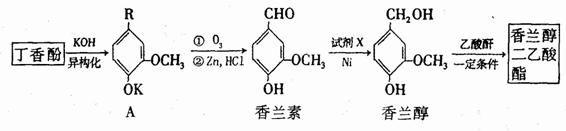
①A的分子式为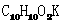 ,A中R的结构简式是
。
,A中R的结构简式是
。
②由香兰素生成香兰醇是加成反应,则试剂X的化学式是 。
③写出由香兰醇生成香兰醇二乙酸酯的化学方程式: 。
18. [化学-物质结构与性质](20分)
(I)多项选择题(6分
下列说法一定正确的是:
A. 氯化铯晶体中每个Cs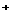 周围与其距离最近的Cs
周围与其距离最近的Cs 有6个(晶体结构如右图)
有6个(晶体结构如右图)
B. 非金属元素间形成的化合物不可能有离子键
C. 离子化合物中可能含有极性共价键或非极性共价键
D. 晶体中一定存在着化学键
E. 金属晶体的熔点都比离子晶体的熔点低
F. 分子晶体中一定有分子间作用力,有的还可能有氢键
(II)(14分)
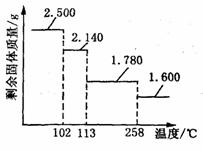
X元素在第3周期中电负性最大,Y、Z元素同主族且位置相邻,Y原子的最外层电子排布为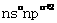 。请填写下列空白。
。请填写下列空白。
(1)第一电离能:Y Z(填“>”、“<”或“=”)。
 (2)XY2是一种高效安全的消毒剂,熔点-59.5℃,沸点10℃,构成该晶体的微粒之间的作用力是
。
(2)XY2是一种高效安全的消毒剂,熔点-59.5℃,沸点10℃,构成该晶体的微粒之间的作用力是
。
(3)ZX2常用于有机合成。已知极性分子ZX2中Z原子采用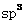 杂化,则该分子的空间构型是
;分子中X、Z原子之间形成
键。(填“
杂化,则该分子的空间构型是
;分子中X、Z原子之间形成
键。(填“ ”或“
”或“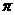 ”)
”)
(4)胆矾晶体(CuSO4·5H2O)中4个水分子与铜
离子形成配位键,另一个水分子只以氢键与相邻微
粒结合。某兴趣小组称取2.500g胆矾晶体,逐渐升
温使其失水,并准确测定不同温度下剩余固体的质量,
得到如右图所示的实验结果示意图。以下说法正确的
是 (填标号)。
A.晶体从常温升至105℃的过程中只有氢键断裂
B.胆矾晶体中形成配位键的4个水分子同时失去
 C.120℃时,剩余固体的化学式是CuSO4·H2O
C.120℃时,剩余固体的化学式是CuSO4·H2O
D.按胆矾晶体失水时所克服的作用力大小不同,
晶体中的水分子可以分为3种
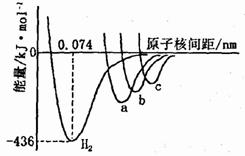
(5)右图中四条曲线分别表示H2、Cl2、Br2、I2分
子的形成过程中能量随原子核间距的变化关系,其中表
示v的是曲线 (填“a”、“b”或“c”),理由是
。
17.(9分)
某学习小组对人教版教材实验“在200 mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15 mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究。
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味。按压此黑色物质时,感觉较硬,放在水中呈漂浮状态。 同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性
④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________________(填序号)。
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:
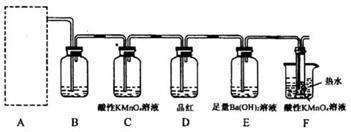
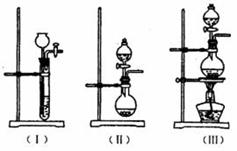
试回答下列问题: ①上图A中最好选用下列装置 (填编号)。
② B装置所装试剂是 ;D装置中试剂的作用是 ; E装置中发生的现象是 。
③ A装置中使蔗糖先变黑的化学反应方程式为 ;后体积膨胀的化学方程式为: 。
④ 某学生按上图进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因 其反应的离子方程式是 。
16.(7分)A、B、C、D、均为中学化学常见的物质,它们间的反应关系如下图所示。已知Al3++3HCO3-==Al(OH)3↓+3CO2↑
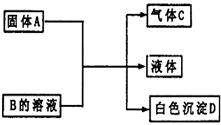 ⑴若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则B的化学式:
。
⑴若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则B的化学式:
。
有关反应的化学方程式为:
⑵若B是正盐,D既可溶于盐酸又可溶于NaOH溶液。
①A是NaHCO3时,该反应的离子方程式为:
。
②A是一种淡黄色固体,且A与B以物质的量之比为2:1相混合时,推知B的化学式为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com