
题目列表(包括答案和解析)
28.(16分) 钠是很活泼的金属,在空气中燃烧的产物是 。
。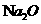 的制取可以通过如下反应完成:
的制取可以通过如下反应完成: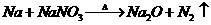 (未配平)。请回答下列问题:
(未配平)。请回答下列问题:
(1) 上述反应的氧化剂是
(写化学式)。制取 时若
时若 与
与 按质量
按质量
比23:17投料,充分反应后收集到的气体体积1.12 (标准状况下),则制得的
(标准状况下),则制得的 的质
的质
量为 kg。
(2) 制取 时由于设备密封性不好而进入了少量空气,导致制得的
时由于设备密封性不好而进入了少量空气,导致制得的 产品中含有
产品中含有
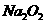 杂质。现有氧化钠样品mg (假设只含有
杂质。现有氧化钠样品mg (假设只含有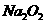 杂质),请根据下面可选用的仪器和试剂,设计一种实验仪器、试剂组合,以完成样品中氧化钠含量的测定。相关内容按要求填写在表格中。
杂质),请根据下面可选用的仪器和试剂,设计一种实验仪器、试剂组合,以完成样品中氧化钠含量的测定。相关内容按要求填写在表格中。
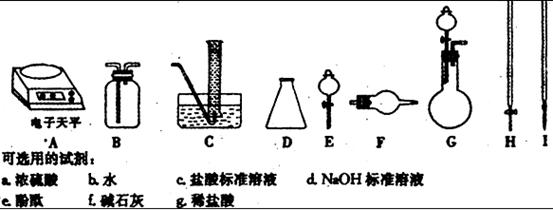
|
实验过程中发生反应的化学方程式 |
实验所需仪器(用字母表示) |
实验所需试剂(用字母表示) |
实验需直接测定的有关物理量(用文字说明) |
|
|
|
|
|
(3) 某学生设计了以下实验方案来测定该样品中 的质量分数,其操作流程和实验数据如下:
的质量分数,其操作流程和实验数据如下:

该氧化钠样品中 的质量分数为
。
的质量分数为
。
27.(15分) 高锰酸钾是深紫色的针状晶体,是最重要也是最常用的氧化剂之一,可用来漂
白棉、毛、丝等纺织品。已知温度高于80℃高锰酸钾会部分分解。
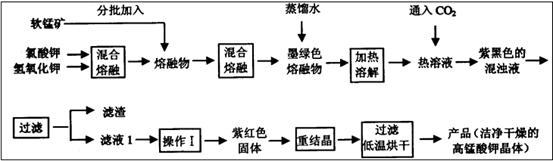
实验室以软锰矿 (主要成份是 ) 为主要原料来制备高锰酸钾,分两步进行:
) 为主要原料来制备高锰酸钾,分两步进行:
第一步是将+4价的锰氧化成为+6价,反应方程式为:

第二步是在通入 条件下使+6价的锰歧化为+7价和+4价 (
条件下使+6价的锰歧化为+7价和+4价 ( )。
)。
实验流程如下:
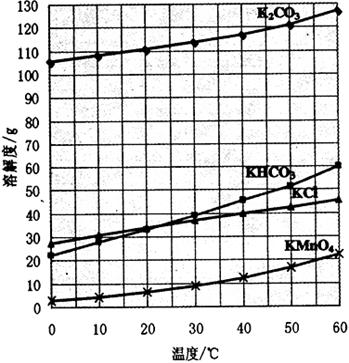
几种物质的溶解度随温度变化如上图所示。回答下列问题:
(1) 下列仪器中,混合熔融氯酸钾和氢氧化钾固体过程中需要用到的是 ( )。
A.蒸发皿 B.玻璃棒 C.铁棒 D.瓷坩埚 E.铁坩埚 F.烧杯 G.酒精灯 H.泥三角
(2) 通入适量二氧化碳,锰酸钾发生岐化反应的化学方程式是
。
(3) 通入适量的二氧化碳直到锰酸钾全部岐化为止 (可用玻璃棒蘸取溶液点于滤纸上.如果
滤纸上只有紫红色而无绿色痕迹,即表示锰酸钾己歧化完全) ,二氧化碳的通入量不能过多
的原因是 。
(4) 操作I应该在 (填“加压”、“减压”、“常压”)情况下蒸发,其理
由是 。
(5) 除了酸化可以使锰酸钾发生岐化反应生成高锰酸钾外 (歧化法) ,通过使用惰性电极电解锰酸钾溶液也可以制备高锰酸钾。电解时阴极有气泡产生,则阳极的电极反应式为
;
与歧化法相比,电解法主要的优点是 。
26.(14分) 咖啡酸 (下式中的A) 是某种抗氧化剂成分之一,A与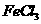 溶液反应显紫色。
溶液反应显紫色。

(1) 咖啡酸中含氧官能团的名称为 。
(2) 咖啡酸可以发生的反应是 (填写序号)。
①氧化反应 ②加成反应 ③酯化反应 ④加聚反应 ⑤消去反应
(3) 咖啡酸可看作1,3,4-三取代苯,其中两个相同的官能团位于邻位,取代基中不含支链。则咖啡酸的结构简式为 。
咖啡酸分子若仅因苯环上的三个取代基在苯环上的位置不同共有 种同分异构
体 (不包括咖啡酸分子本身)。
(4) 写出D与足量的氢氧化钠溶液共热时反应的化学方程式:
。
(5) 蜂胶的主要活性成分为CPAE,分子式为 ,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇,且分子结构中无甲基,则咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为:
。
,该物质在一定条件下可水解生成咖啡酸和一种醇,该醇为芳香醇,且分子结构中无甲基,则咖啡酸跟该芳香醇在一定条件下反应生成CPAE的化学方程式为:
。
25.(13分) A、B、C、D、E是中学化学常见的五种元素,原子序数依次增大,其结构或性
质信息如下表:
|
元素 |
结构或性质信息 |
|
A |
其原子最外层电子数是内层电子数的2倍 |
|
B |
基态原子最外层电子排布为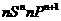 |
|
C |
非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
|
D |
单质在常温、常压下是气体。基态原子的M层上有1个未成对的P电子 |
|
E |
其与A形成的合金为目的用量最多的金属材料 |
(1) E元素基态原子的电子排布式是 。
(2) 在一定条件下,B与D可形成一种化合物 (分子中每个原子最外层均为8电子结构),常温下为淡黄色液体,该物质遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种产物具有漂白性,写出该化合物与水反应的化学方程式:
。
(3) E单质在海水中易发生电化学腐蚀,写出该电化学腐蚀的正极电极反应式
。
(4) 己知1克单质C完全燃烧放出热量为Q KJ,写出表示C燃烧热的热化学方程式
。
(5) 比较A与C的电负性:A C
(填<,=或>)。A与D形成的一种常见化合物,常温下为液体,是良好的有机溶剂,其分子中含有的共价键类型是 。(填“ 键”
键”
或“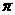 键”)。
键”)。
13.将mg铁粉与一定浓度的硝酸充分反应后,铁粉完全溶解,生成的气体与VL(标准状
况下)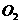 混合后,恰好能完全被水吸收,则m和V的关系不可能是
混合后,恰好能完全被水吸收,则m和V的关系不可能是
A.m=3V B.m=5V C.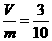 D.
D.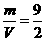
第II卷 (非选择题 共180分)
12.1 L某溶液中含有的离子如下表:
|
离子 |
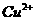 |
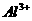 |
 |
 |
|
物质的量浓度(mol/L) |
1 |
1 |
a |
1 |
用惰性电极电解该溶液,当电路中有3 mol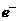 通过时(忽略电解时溶液体积的变化及电
通过时(忽略电解时溶液体积的变化及电
极产物可能存在的溶解现象),下列说法正确的是
A.电解后溶液的pH=0 B.a=3
C.阳极生成1.5 mol 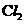 D.阴极析出的金属是铜与铝
D.阴极析出的金属是铜与铝
11.已知某化学反应的平衡常数表达式为K=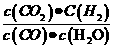 ,在不同的温度下该反应的
,在不同的温度下该反应的
平衡常数值分别为:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
1.67 |
1.11 |
1.00 |
0.60 |
0.38 |
下列有关叙述不正确的是:
A.该反应的化学方程式是: (g)+
(g)+ (g)
(g) 
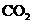 (g)+
(g)+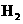 (g)
(g)
B.上述反应的正反应是放热反应.
C.如果在一定体积的密闭容器中加入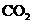 和
和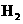 各1 mol,5 min后温度升高到830℃,此时测得
各1 mol,5 min后温度升高到830℃,此时测得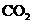 为0.4 mol时,该反应为平衡状态。
为0.4 mol时,该反应为平衡状态。
D.某温度下,如果平衡浓度符合下列关系式: ,判断此时的温度是1000℃.
,判断此时的温度是1000℃.
10.25℃时,下列各溶液中有关物质的量浓度关系正确的是
A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:
c( ) > c(
) > c(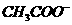 ) > c(
) > c(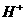 ) > c(
) > c( )
)
B.常温下将等体积等物质的量浓度的醋酸钠与盐酸两溶液混合:
c( ) > c(
) > c( ) > c(
) > c(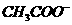 ) > c(
) > c(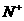 ) > c(
) > c( )
)
C.25℃时,若10mL盐酸(pH=a)与100mL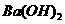 溶液(pH =b)混合后恰好中和,则a+b=13
溶液(pH =b)混合后恰好中和,则a+b=13
D.pH相同的 溶液、
溶液、 溶液、
溶液、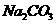 溶液、
溶液、 溶液:
溶液:
c( ) > c(
) > c( ) > c(
) > c(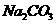 ) > c(
) > c(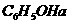 )
)
9.根据下列实验现象,所得结论正确的是
|
实验 |
实验现象 |
结论 |
|
A. |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
活动性:Al>Fe>Cu |
|
B. |
左边棉花变为橙色,右边棉花变为蓝色 |
氧化性: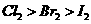 |
|
C. |
白色固体先变为淡黄色,后变为黑色( ) ) |
Ksp: |
|
D. |
锥形瓶中有气体产生,烧杯中液体变浑浊 |
非金属性:S<C>Si |
8.设阿伏加德罗常数的数值为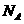 ,下列说法正确的是
,下列说法正确的是
A.1mol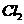 与1mol
与1mol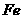 反应,转移的电子数为
反应,转移的电子数为
B.含0.2 mol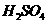 的浓硫酸与足量铜反应,生成
的浓硫酸与足量铜反应,生成 的分子数为0.1
的分子数为0.1 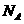
C.1.1mol·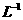 的
的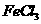 溶液中含有0.1
溶液中含有0.1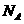 个
个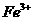
D.在标准状况下,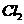 和
和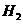 的混合气22.4升,光照后原子总数为
的混合气22.4升,光照后原子总数为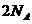
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com