
题目列表(包括答案和解析)
19.(11分)已知A、B、C、D、E五种元素的原子序数依次增大,A、B、C均为短周期元素,其中A元素原子的最外层电子数是次外层的3倍,A、B、C三种元素的简单离子都具有相同的电子层结构,B与C在同一周期,且二者的原子最外层电子数之和等于4;D为常见的金属元素,有三种氧化物,其中两种在常温下为黑色固体,E元素的单质易溶于有机溶剂苯,其溶液呈紫色。试回答下列问题:
(1) C元素的离子结构示意图_____________________。
(2) A与B可形成化合物B2A,试用电子式表示其形成过程________________________。
(3) E元素在周期表中的位置:第______周期第_______族。
(4) 下图是与上述元素相关的常见物质相互反应得到的主要产物的框图:(反应条件从略)
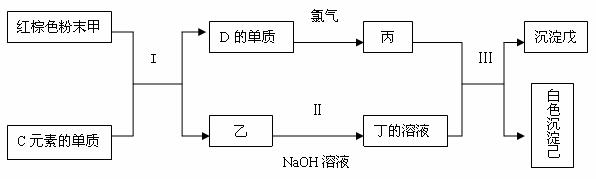
据图回答:
① 沉淀戊的化学式_____________。
② 反应I的化学方程式___________________________________________。
③ 反应II的离子方程式___________________________________________。
④ 丙与明矾一样,也可作净水剂,结合离子方程式说明丙的净水原理_____________。
18.(10分)中国“嫦娥一号” 成功登月,它使用的推进剂是液态氢气和液态氧气。已知
H2(g)= H2(l);△H=-0.92kJ/mol
O2(g)= O2(l);△H=-6.84kJ/mol
H2O(l)= H2O(g);△H=+44.00kJ/mol
H2(g)+ 1/2 O2(g) H2O(l);△H=-285.80kJ/mol
(1)请写出液态氢气和液态氧气生成气态水的热化学方程式:____________________。
(2)氢气、氧气不仅燃烧时能释放热能,还能形成原电池将其转化为电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解质溶液为H2SO4溶液,其正极的反应式为:_____________,工作一段时间后,电解质溶液的PH将_____(填增大、减小、不变)。
(3)若用氢氧燃料电池完成在铁制品上镀锌的实验,铁制品应与氢氧燃料电池的_____(填H2或O2)电极相连,阳极的反应式为_________,实验中发现阴极有少量气体产生,你认为该气体可能是______(填化学式)。
(4)若该氢氧燃料电池能量转化及其在该镀锌装置中能量的总利用率为50%,电镀一段时间后,铁制品的质量增加了1.3g,该氢氧燃料电池理论上至少需消耗在标准状况下的氢气_________毫升。

17.(10分)在一密闭容器中加入A、B、C三种气体,在温度T ℃和(T+10)℃的不同时刻,测得各物质的浓度如下表。
|
温度 |
T ℃ |
(T+10)℃ |
|||
|
测定时刻/s |
t1 |
t2 |
t3 |
t4 |
t5 |
|
c(A)/(mol·L-1) |
6 |
3 |
2 |
2 |
2.2 |
|
c(B)/(mol·L-1) |
5 |
3.5 |
3 |
3 |
3.1 |
|
c(C)/(mol·L-1) |
1 |
2.5 |
3 |
3 |
2.9 |
请回答下列问题:
 (1)T℃时,从t1到t2内,以c(B)来表示的平均反应速率为________。
(1)T℃时,从t1到t2内,以c(B)来表示的平均反应速率为________。
(2)该反应的化学方程式为:______________________________ (系数以最简整数比表示)。
(3)T℃时,该反应的平衡常数K=__________________。
(4)T℃时,该反应达到平衡后,增大压强,平衡常数K将________(填增大、减小、不变)。
(5)该反应的正反应为____(填放热、吸热)反应。
16、(10分)除掉下列物质中的杂质,括号内为杂质
|
|
加入试剂或方法 |
离子方程式 |
|
CO2(HCl) |
|
|
|
碳粉(MnO2) |
|
|
 Fe2O3(Al2O3) Fe2O3(Al2O3) |
|
|
|
Na2CO3溶液(NaHCO3) |
|
|
|
FeCl3(FeCl2) |
|
|
15、常温下,0.1mol/L Na2CO3溶液中各微粒浓度关系正确的是
A.c(Na+)>c(CO32-)>c(HCO3-)>c(H2CO3)
B.c(Na+)>c(CO32-)>c(H+)>c(OH-)
C.c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
第二卷(共50分)
14、能够使反应Cu+2H2O=Cu(OH)2+H2↑发生的是
A.铜片作原电池的负极,碳棒作原电池的正极,氯化钠作电解质溶液
B.铜锌合金在潮湿空气中发生电化学腐蚀
C.用铜片作阴、阳电极,电解硫酸钠溶液
D.用铜片作阴、阳电极,电解硫酸铜溶液
13、往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,发现有少量金属析出,过滤后往滤液中滴加盐酸有白色沉淀生成,则析出的少量金属可能是
A.Cu和Ag B.Cu C.Ag D.无法判断
12.在一恒定的容器中充入2 mol A和1 mol B发生反应:
 2A(g)+B(g) x C(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6 mol、B:0.3 mol、C:1.4 mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为
2A(g)+B(g) x C(g),达到平衡后,C的体积分数为W%;若维持容器的容积和温度不变,按起始物质的量A:0.6 mol、B:0.3 mol、C:1.4 mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为
A.只能为2 B.只能为3 C.可能是2,也可能是3 D.无法确定
11、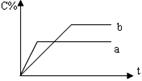 右图表示可逆反应A(g)+B(g) nC(g) ΔH<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线,有关叙述一定正确的是( )
右图表示可逆反应A(g)+B(g) nC(g) ΔH<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线,有关叙述一定正确的是( )
A.a表示有催化剂,而b无催化剂
B.若其他条件相同,a比b的温度高
C.若其他条件相同,a比b的压强大,n>2
D.反应由逆反应方向开始
10、在一定条件下,在密闭容器中的反应为:2NO(g)+O2(g) 2NO2(g)
2NO2(g)

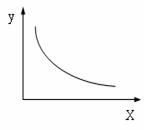 ΔH= -42.3KJ/mol, 达到平衡状态。当改变其中一个条件X,Y 随X的变化符合图中曲线的是
ΔH= -42.3KJ/mol, 达到平衡状态。当改变其中一个条件X,Y 随X的变化符合图中曲线的是
A、当X表示压强时,Y表示 ΔH的变化趋势
B、当X表示温度时,Y表示平衡常数的变化趋势
C、当X表示温度时,Y表示正反应速率的变化趋势
D、当X表示压强时,Y表示该反应混合物中c(NO2)的变化趋势
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com