
题目列表(包括答案和解析)
7.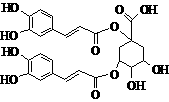 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如下图所示,有关洋蓟素的说法正确的是
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如下图所示,有关洋蓟素的说法正确的是
A.1mol洋蓟素最多可与11mol H2反应
B.不能与氯化铁溶液发生显色反应
C.一定条件下能发生酯化反应和消去反应
D.1mol洋蓟素最多可与5mol NaOH反应
6.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4L甲醇中含有的氧原子数为1.0NA
B.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
C.标准状况下,2.24L Cl2与足量的稀NaOH 溶液反应,转移电子总数为0.2NA
D.常温常压下,46g NO2 与 N2O4的混合气体中含有的原子总数为3NA
5.下列有关实验的现象描述正确的是
A.氢气在氯气中燃烧,火焰呈苍白色,产生大量白雾
B.硫在空气中燃烧,发出明亮的蓝紫色火焰,产生有刺激性气味的气体
C.铜在氯气中燃烧,产生白烟,加水溶解后可能得到绿色溶液
D.用洁净的玻璃棒蘸取碳酸钾粉末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰
4.下列有关化学用语正确的是
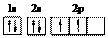
A.碳原子的轨道表示式:
B.次氯酸分子的电子式: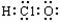
C.CH4Si的结构式: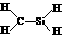 D.质量数为137的钡原子:
D.质量数为137的钡原子: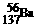
3.下列生产工艺不能体现“绿色化学”或环保思想的是
A.海水提镁:用电解氯化镁产生的氯气制取盐酸
B.工业制硫酸:提高尾气排放的烟囱高度
C.工业制胆矾:使用稀硫酸、双氧水溶解铜
D.火力发电:在燃煤中加入适量生石灰
2.下列事实得出的结论错误的是
A.维勒用无机物合成了尿素,突破了无机物与有机物的界限
B.门捷列夫在前人的基础上发现了元素周期律,表明科学研究既要继承又要创新
C.C60是英国和美国化学家共同发现的,体现了国际科技合作的重要性
D.科恩和波尔因物质结构理论方面的贡献获诺贝尔化学奖,意味着化学已成为以理论研究为主的学科
1.联合国气候变化大会于2009年12月7~18日在哥本哈根召开。中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。有效“减碳”的手段之一是节能。下列制氢方法最节能的是
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O 2H2↑+O2↑
D.天然气制氢:CH4+H2O CO+3H2
CO+3H2
28、(14分)黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
 Ⅰ、将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2 2Fe2O3
+ 8SO2
Ⅰ、将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2 2Fe2O3
+ 8SO2

Ⅱ、反应结束后,将乙瓶中的溶液进行如下处理:

|
III、测定铁元素含量的实验步骤如图所示。

问题讨论:
(1)I中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有______
___________。
(2)II中,所加H2O2溶液(氧化剂)需足量的理由是__________。
(3)该黄铁矿中硫元素的质量分数为__________。
(4)III的步骤②中,若选用铁粉作还原剂,你认为合理吗?_______,理由是:_______。
(5)III的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________。
2010年安庆市高三第二学期重点中学联考
27、(14分)氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如图所示。
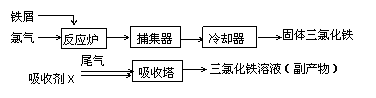
(1)取0.5mL三氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为____________。
(2)下表是六水合氯化铁在水中的溶解度。
六水合氯化铁的溶解度
|
温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
|
溶解度 /(g/100g H2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是_______________。
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的分子式为:______
(4)吸收剂X是________;吸收塔中吸收剂X的作用是________。
(5)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00 mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol/L Na2S2O3溶液滴定(I2+2S2O32- = 2I- + S4O62-),共用去V mL.则样品中氯化铁的质量分数为____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com