
题目列表(包括答案和解析)
26. 利用Y型管与其它仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
|
(1) |
 |
实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为________________;硫化亚铁处加水的目的是___________________。 |
|
(2) |
 |
实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧Y型管中应放置的药品是_________、_________(必要时可以加热),该沉淀的化学式为____________。 |
|
(3) |
 |
实验目的:探究电石气中的成分 ① 装置A中的化学反应方程式为: _________________________________________。 ②B装置中出现黑色沉淀,可判断电石气中含有________;C装置的作用为__________________。 ③为验证电石气的主要成分,D中盛放________。 |
|
(4) |
 |
实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是__________ _________________________________________。 ②若称得锌铁合金的质量为0.117g,量气管中初读数为1. 00mL,末读数为45.80mL,则合金中铁的含量为________%(保留2位小数,已折算标况)。 |
25. 1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)
+ 4H2(g)  Na2S(s)
+ 4H2O(g) 。
Na2S(s)
+ 4H2O(g) 。
(1)该反应的平衡常数表达式为____________________。
已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
(2)该温度下,在2L盛有1.42 g Na2SO4的密闭容器中通入H2气体,5分钟后测得固体质量为1.10 g。则5分钟内H2的平均反应速率为_________________。
(3)能说明该反应已达到平衡状态的是______(填序号)。
a. 容器内压强保持不变 b. 容器内气体密度保持不变
c. c(H2) = c(H2O) d. υ正(H2) =υ逆(H2O)
(4)向平衡体系中加入焦炭,下列图像正确的是___________(填序号)。
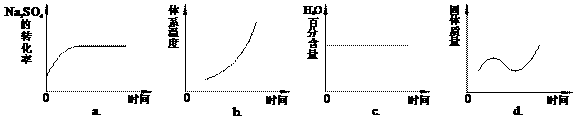
(5)用有关离子方程式说明上述反应产物水溶液的酸碱性______________________________,欲使该溶液中S2-浓度增大,平衡逆向移动,可加入的物质是____________________。
24. 作为世界卫生组织(WHO)推荐的A1级广谱、安全、高效消毒剂,二氧化氯(ClO2)在水处
|
理领域有着广泛应用。与氯气相比,它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。 (1)反应时,ClO2生成ClO2-、Cl-的转化率与溶液的pH的关系如图所示。则pH= 8时,ClO2被还原为_____________。 |
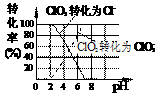 |
(2)亚氯酸根离子(ClO2-)对人体不利。欲在弱碱性条件下将水中的ClO2-转化为Cl-除去,若该反应体系中的物质有:NaClO2、Fe(OH)3、NaHCO3、FeCl2、NaCl、H2O、CO2。写出、配平有关化学方程式,并标出电子转移的方向和数目:
_____________________________________________________________________________。
(3)以下是ClO2的两种制备方法:
方法一:2NaClO3 + 4HCl → 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O
方法二:2NaClO3 + H2O2 + H2SO4 → 2ClO2↑+ O2↑+ Na2SO4 + 2H2O
① 方法一,当有0.2mol电子发生转移时,参与反应的还原剂为_________ mol。
② 方法二:该反应中H2O2_________(填序号)。
a. 发生氧化反应 b. 仅做氧化剂 c. 既被氧化又被还原 d. 既未被氧化也未被还原
③ 用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是___________________。
23. 组成生命细胞的11种宏量元素(约占人体总质量的99.97%),全部位于周期表的前20号。其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素。
(1)这六种元素中除H、C、O、P、S外,应该还有______(写元素符号),它的原子最外层共有______种不同运动状态的电子;与它同周期,且单质熔点最高的元素在周期表中的位置_______________________。
(2)糖类是人体获得能量的来源之一。已知1mol 葡萄糖在人体内完全氧化为二氧化碳和水,放出2804 kJ的热量,该反应的热化学方程式_______________________________________。
(3)CO2是一种温室气体,它的电子式为______________,将其转变其他化工原料,必须破坏的化学键属于_________(填“极性”或“非极性”)键。
(4)元素周期表中元素的性质存在递变规律,下列关系正确的是______(填序号)。
a. 离子半径:S2->Na+>O2->H+ b. 与水反应的剧烈程度:K>Na>Mg>Ca
c. 熔点:CO2>SiO2>Na2O>SO3 d. 还原性:PH3>H2S>HCl>HF
(5)下表为部分非金属元素与氢形成共价键的键长与键能数据:
|
共价键 |
H-H |
H-F |
H-Cl |
H-Br |
H-O |
H-S |
H-N |
H-P |
|
键长(pm) |
74 |
92 |
127 |
141 |
98 |
135 |
101 |
321 |
|
键能(kJ/mol) |
436 |
568 |
432 |
368 |
464 |
364 |
391 |
142 |
根据表中数据,归纳共价键键能与键长的关系 _______________________________________。
22. 向200 mL 0.1mol/L 的Fe(NO3)2溶液中加入一定量NaOH,使Fe2+完全沉淀,加热、蒸干并灼烧混合物直至质量不再变化,此时固体的质量可能为
A. 1.60 g B. 2.76 g C. 4.36 g D. 5.54 g
第II卷(共84分)
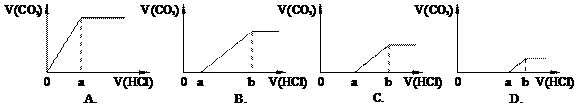
21. 向等量的NaOH溶液中分别通入CO2气体。因CO2的通入量不同,得到组分不同的溶液M。若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)关系如下,(注:①假设CO2全部逸出;②C图中oa=ab)。其中M中只有1种溶质的是
20. 现有常温下的四种溶液(如下表):
|
|
① |
② |
③ |
④ |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
|
pH |
11 |
11 |
3 |
3 |
下列有关叙述中正确的是
A. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
B. 将③、④分别稀释到pH = 5,由水电离出氢离子的浓度均减小100倍
C. 在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
D. 将①、④两种溶液等体积混合,所得溶液中:c(OH-) :c(H+ ) >1
19. 下列离子方程式书写正确的是
A. 碳酸钙溶于稀硝酸:CO32― + 2H+ → CO2↑+ H2O
B. 氯化铜溶液中加入NaHS溶液: Cu2+ + HS― → CuS↓+ H+
C. 碳酸钠溶液中通入少量二氧化碳:CO32- + CO2 + H2O → 2HCO3-
D. 硫酸氢铵溶液中加入少量氢氧化钠溶液:NH4+ + OH― → NH3↑+ H2O
18. 下列说法正确的是
A. 分子晶体中,可能不存在共价键,但一定存在分子间作用力
B. 两种元素组成的分子中一定只有极性键
C. 只含共价键的物质,一定是共价化合物
D. 氧化还原反应中,一种元素化合价上升,一定有另一种元素化合价下降
17. 把铝粉与Fe3O4的混合物,分为两等份。前一份在高温下恰好完全反应,之后将生成物与足量盐酸充分反应;后一份直接加入足量NaOH溶液充分反应。前后两种情况下生成的气体在同温同压下的体积比是
A. 1:1 B. 3:4 C. 9:8 D. 4:3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com