
题目列表(包括答案和解析)
8.下列物质溶于水后,能使水的电离程度增大的是
A.NO2 B.Ba(OH)2 C.Cl2 D.CH3COONa
7.下列说法正确的是
A.煤的干馏、石油的分馏都只发生了物理变化
B.棉、麻、丝、毛完全燃烧都只生成CO2和H2O
C.甲烷和苯都能发生取代反应
D.乙醇和乙酸互为同分异构体
6.含元素种类最少的物质是
A.氨水 B.氯水 C.重水 D.硬水
31.[化学-有机化学基础](13分)
乙基香兰素()是世界上最重要的合成香料之一,其结构如下图所示
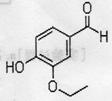 (1)以下有关乙基香兰素的推测不正确的是
。(填标号)
(1)以下有关乙基香兰素的推测不正确的是
。(填标号)
A.能发生银镜反应
B.能与氢氧化钠溶液反应
C.不属于芳香烃
D.分子内含有1个碳氧双键、3个碳碳双键
(2)写出符合下列条件的乙基香兰素的同分异构体X的结构简式: 。
i.遇氯化铁溶液显紫色; K^S*5U.C
ii.苯环上有2个取代基,且苯环上的一氯代物只有2种;
iii.X可发生水解反应生成M和N两种有机物,N的质谱图显示相对分子质量为32.
(3)乙基香兰素的另一种同分异构体Y,分子中苯环上只有1个取代基,Y可以和碳酸氢钠溶液反应生成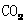 。已知:
。已知:
Y可发生如下转化:
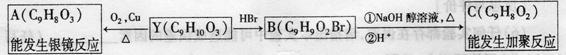
①Y分子中的含氧官能团有 、 (填名称);
②C的结构简式为 ;
③YA反应的化学方程式为 ,反应类型为 。
2010年三明市普通高中毕业班质量检查
30.[化学-物质结构与性质](13分) K^S*5U.C
W、X、Y、Z4种元素原子序数依次减小。W的原子序数为24;X原子p轨道共有11个电子;Y是第三周期主族元素,其部分电离能(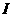 )如下表;Z原子价电子排布式为
)如下表;Z原子价电子排布式为 。请回答下列问题:
。请回答下列问题:
|
电离能/KJ·mol·L-1 |
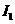 |
 |
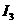 |
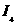 |
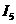 |
|
Y |
584 |
1823 |
2751 |
11584 |
14837 |
(1)W基态原子的电子排步式为 。
(2)点负性:X Y(填“>”、“=”或“<”)。
(3)R是与X同主族的短周期元素。R的氢化物沸点比X的氢化物更高,原因是:
。
(4)氨为常见化工原料,氨分子中N原子采用 杂化,该分子的空间构型为
,分子中N、H原子之间形成
(填“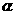 ”或“
”或“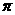 ”)键;已知
”)键;已知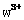 能与氨分子形成配离子
能与氨分子形成配离子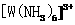 ,该配离子中存在的化学键有 。(填标号)
,该配离子中存在的化学键有 。(填标号)
A.金属键 B.离子键 C.共价键 D.配位键
25.(16分)
铜及其化合物在生产和生活实际中应用广泛。
Ⅰ.某学习小组对粗铜提纯后的阳极泥(主要成分为银、金)进行如下实验。

(1)操作③所需的仪器有:烧杯、 。
(2)为了回收金,他们查阅了有关资料如下表: K^S*5U.C
|
编号 |
常温下反应 |
化学平衡常数 |
|
反应1 |
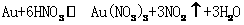 |
<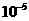 |
|
反应2 |
 |
>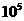 |
从资料中可知,常温下金很难与硝酸反应,但却可溶于王水(浓硝酸与浓盐酸按体积比1:3的混合物)。请你运用化学平衡移动原理,简要说明金能溶于王水的原因: 。 K^S*5U.C
Ⅱ.学习小组对无水硫酸铜分解的产物进行实验探究。
[提出问题]碳酸钙受热分解生成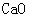 和
和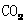 ,那么无水碳酸铜受热分解也只生成
,那么无水碳酸铜受热分解也只生成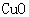 和
和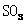 吗?
吗?
[设计实验]按下图装置进行试验。
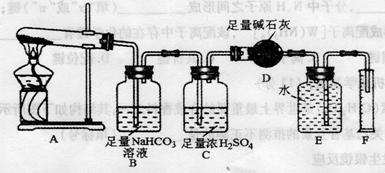
[实验过程]a.准确称取无水硫酸铜2.40g于装置A试管中加热,直至固体全部变为黑色,经验证该黑色粉末为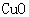
b.实验中,观察到装置E中的水部分被排入量筒中;实验结束后,测得量筒中水的体积为112 mL(已折算成标准状态下气体的体积),并测得干燥管D的质量增加了1.32g。
(3)装置C的作用 。
(4)根据装置E、F中现象,推测还有气体
(填分子式)生成;实验生成的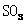 为
mol。
为
mol。
(5)装置A中反应的化学方程式为 。
[实验结论]无水硫酸铜受热分解不仅仅生成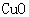 和
和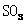 。
。
[反思与评价]
(6)任何实验都存在误差,请指出本实验中可能造成误差的因素 。(任写2点)
选考部分
24.(14分)
随着环保意识增强,清洁能源越来越受到人们关注。
(1)甲烷是一种理想的洁净燃料。已知:
CH4(g)+2O2(g) = CO2(g)+2H2O(g)  =-802.3kJ·mol-1
=-802.3kJ·mol-1
H2O(1) = H2O(g)  =+44.0kJ·mol-1
=+44.0kJ·mol-1
则4.8g甲烷气体完全按燃烧生成液态水,放出热量为 。
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。
该反应为CH4(g)+ H2O(g)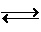 CO(g)+3H2(g)
CO(g)+3H2(g)  =+206.1kJ·mol-1。
=+206.1kJ·mol-1。
①若800CC时,反应的化学平衡常数K=l.O,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表。
|
CH4 |
H2O |
CO |
H2 |
|
3.0mol·L-1 |
8.5mol·L-1 |
2.0mol·L-1 |
2.0mol·L-1 |
则此时正、逆反应速率的关系是 。(填标号)
A.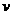 (正)>
(正)>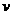 (逆) B.
(逆) B.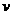 (正)<
(正)<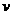 (逆)
(逆)
C.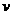 (正)=
(正)=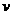 (逆) D.无法判断
(逆) D.无法判断
②为了探究温度、压强对上述化学反应速率的影响,张山同学设计了以下三组对比实验(温度为360℃或480℃、压强为101 kPa或303 kPa,其余实验条件见下表)。
|
实验序号 |
温度/℃ |
压强/kPa |
CH4初始浓度/ mol·L-1 |
H2O初始浓度/ mol·L-1 |
|
1 |
360 |
P |
2.00 |
6.80 |
|
2 |
t |
101 |
2.00 |
6.80 |
|
3 |
360 |
101 |
2.00 |
6.80 |
表中t= ,P= ;
设计实验2、3的目的是 ;
实验l、2、3中反应的化学平衡常数的大小关系是 (用 表示)。
表示)。
(3)利用作催化剂,通过两步反应可将水分解制得氢气,第一步反应为:
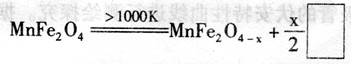
则框内物质为 ;第二步反应的化学方程式为 (可不写反应条件)。
23.(15分)
X、Y、Z、M是由短周期元素组成的化合物;X、Y、Z均含有钠元素,且Y、Z均含有三种元素;Z的溶液显碱性。请回答下列问题:
(1)X为淡黄色粉末,可作潜水艇的供氧剂,则X为 。X中除钠元素外,其它元素的原子结构示意图为 。 K^S*5U.C#
(2)Y、Z、M有关实验如下表:
|
实验序号 |
 主要实验步骤及实验现象 主要实验步骤及实验现象 |
|
1 |
向Y溶液中加入稀H2S04,产生淡黄色沉淀和无色有刺激性气味的气体,该气体能使品红溶液退色。 |
|
2 |
向M溶液中连续滴加Z溶液,初有白色沉淀,后沉淀溶解。 |
|
3 |
向M稀溶液中滴加硝酸酸化的硝酸银溶液,产生白色沉淀。 |
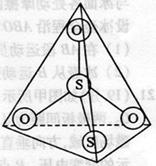
①Y中阴离子的结构如右上图所示,可以看成是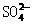 中的一个O原子被S原子所替代,请写出Y与稀H2S04反应的离子方程式:
。
中的一个O原子被S原子所替代,请写出Y与稀H2S04反应的离子方程式:
。
②写出含0.1mol Z的溶液与20 mL 2.5 mol·L-1 M的溶液反应的化学方程式: 。
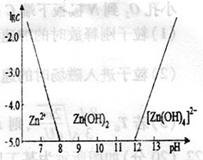 (3)如右下图所示,横坐标表示常温下溶液的pH,纵坐标表示
(3)如右下图所示,横坐标表示常温下溶液的pH,纵坐标表示
离子浓度的对数。请回答下列问题:
①ZnCl2溶液呈酸性的原因是 。
(用离子方程式表示)
②往ZnCl2溶液中加入足量Z溶液,反应的离子方程式为: K^S*5U.C#
。从图中数据可计算常温下Zn(OH)2的为
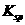 。
。
12.镁--H2O2酸性电池采用海水作电解质(加入一定量酸),下列说法正确的是
A.电池总反应为Mg+H2O2+2H+=Mg2++ 2H2O
B.负极反应为H2O2+2e-+ 2H+= 2H2O
C.电池工作时,正极周围海水的pH减少
D.电池工作时,溶液中的H+向负极移动
第Ⅱ卷
必考部分
11.25时,部分弱酸的电离平衡常数如下表:
|
弱酸 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数 |
1.8×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
下列有关说法正确的是
A.等物质的量浓度溶液的pH关系为pH(NaCN)>pH(Na2CO3)>pH(CH3COONa
B.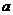 mol·L-1HCN溶液与
mol·L-1HCN溶液与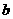 mol·L-1NaOH溶液等体积混合后,所得溶液中
mol·L-1NaOH溶液等体积混合后,所得溶液中
C(Na+)>c(CN-),则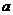 一定小于
一定小于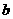
C.往冰醋酸中逐滴加水,溶液的导电性先增大后减小
D.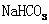 和
和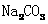 的混合液中:
的混合液中: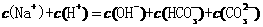
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com