
题目列表(包括答案和解析)
9.燃放烟花爆竹是中国的一种传统。据报道,2009年的元宵节当晚,北京因过渡燃放出现了少有的严重污染的天气。下列有关烟花爆竹说法正确合理的是( )
A.绚丽缤纷的烟花中可能添加了含钾、钠、钙、铜等某些金属元素的化合物
B.燃放烟花爆竹时的主要污染物是CO、CO2 、SO2、烟尘等物质
C.燃放烟花爆竹时只发生了化学变化,没有物理变化
D.为了保证燃放烟花爆竹时的空气质量,应该同时进行人工降雨除掉污染物
31. [化学-有机化学基础](13分)
丁香酚、香兰素、乙酸香兰素都是重要的香料和食品添加剂,它们的结构简式如下:

请填写下列空白。
(1)丁香酚是合成香兰素的原料,鉴别丁香酚和香兰素可选用的试剂是 。
(2)丁香酚在一定条件下发生加聚反应,该反应产物的结构简式为 。
(3)乙酸香兰素在酸性条件下发生水解反应的化学方程式为 。
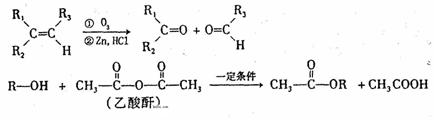 (4)已知:
(4)已知:
以丁香酚为原料合成香兰醇二乙酸酯的流程如下:

①A的分子式为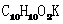 ,A中R的结构简式是 。
,A中R的结构简式是 。
②由香兰素生成香兰醇是加成反应,则试剂X的化学式是 。
③写出由香兰醇生成香兰醇二乙酸酯的化学方程式: 。
30. [化学-物质结构与性质](13分)
X元素在第3周期中电负性最大,Y、Z元素同主族且位置相邻,Y原子的最外层电子排布为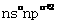 。请填写下列空白。
。请填写下列空白。
(1)第一电离能:Y Z(填“>”、“<”或“=”)。
(2)XY2是一种高效安全的消毒剂,熔点-59.5℃,沸点10℃,构成该晶体的微粒之间的作用力是 。
(3)ZX2常用于有机合成。已知极性分子ZX2中Z原子采用 杂化,则该分子的空间构型是
;分子中X、Z原子之间形成
键。(填“
杂化,则该分子的空间构型是
;分子中X、Z原子之间形成
键。(填“ ”或“
”或“ ”)
”)
 (4)胆矾晶体(CuS04·5H20)中4个水分子与铜
(4)胆矾晶体(CuS04·5H20)中4个水分子与铜
离子形成配位键,另一个水分子只以氢键与相邻微
粒结合。某兴趣小组称取2.500g胆矾晶体,逐渐升
温使其失水,并准确测定不同温度下剩余固体的质量,
得到如右图所示的实验结果示意图。以下说法正确的
是 (填标号)。
A.晶体从常温升至105℃的过程中只有氢键断裂
B.胆矾晶体中形成配位键的4个水分子同时失去
 C.120℃时,剩余固体的化学式是CuS04·H20
C.120℃时,剩余固体的化学式是CuS04·H20
D.按胆矾晶体失水时所克服的作用力大小不同,
晶体中的水分子可以分为3种
(5)右图中四条曲线分别表示H2、Cl2、Br2、I2分
子的形成过程中能量随原子核间距的变化关系,其中表
示v的是曲线 (填“a”、“b”或“c”),理由是
。K$S5*U.CO¥M
25.(15分)
无水氯化镁是制备某种催化剂的中间体。某研究性学习小组设计实验方案进行制取无水氯化镁等实验。请填写下列空白
[实验一]利用下图实验装置(夹持和加热装置省略),在HCl气流中小心加热MgC12·6H2O晶体制取无水氯化镁(无水氯化镁易吸水)。烧瓶中发生的反应为:
NaCl+ H2S04(浓)==NaHS04+ HCl↑
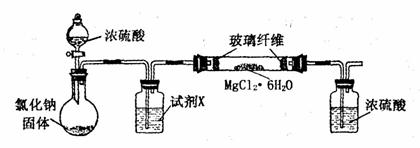
(1)试剂X是 。
(2)该实验装置存在的一个缺陷是 。
[实验二]通过下列步骤,测定实验一所得产物中氯元素含量以确定产物是否含有结晶水:
①称取m1g样品置于烧杯中,充分溶解;
②加入足量硝酸银溶液,充分反应后,过滤;
③洗涤沉淀,干燥至恒重,称得沉淀质量为m2g
(3)若步骤③的操作中未洗涤沉淀,将导致测得的氯元素含量 (填“偏高”或“偏低”)。
(4)若测得m1=10.40,m2=28.70,则所得产品中MgC12·nH2O中的n的值为 。
[实验三]一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验:
|
实验序号 |
氯化镁固体中氯元素含量/% |
温度/℃ |
粉碎方式/ |
催化效果/g·g-1 |
|
1 |
70.97 |
20 |
滚动球磨 |
3.9×104 |
|
2 |
74.45 |
20 |
滚动球磨 |
5.0×104 |
|
3 |
74.45 |
20 |
振动球磨 |
5.9×104 |
|
4 |
 |
100 |
振动球磨 |
|
注:催化效果用单位时间内每克催化剂得到产品的质量来表示。
(5)表中 = 。
= 。
(6)从实验1、2可以得出的结论是 。
(7)设计实验2、3的目的是 。
选考部分
24.(16分)
现代循环经济要求综合考虑环境污染和经济效益。请填写下列空白。K$S5*U.CO¥M
(1)实验室里,可用于吸收S02尾气的一种试剂是 。
(2)某硫酸厂利用S02尾气、废铁屑、空气、水合成绿矾(FeS04·7H20),反应中作
还原剂的物质是 。
(3)高纯氧化铁可作现代电子工业材料。以下是用硫铁矿烧渣(主要成分为Fe203、Fe304、
Fe0、Si02)为原料制备高纯氧化铁(软磁α- Fe203)的生产流程示意图:
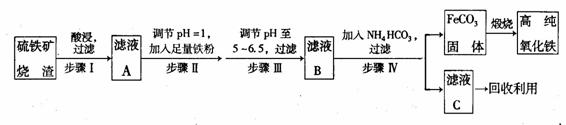
①步骤Ⅲ中可选用 试剂调节溶液的pH(填标号)。K$S5*U.CO¥M
A.稀硝酸 B.双氧水 C.氨水 D.高锰酸钾溶液
②滤液B中含有的主要金属离子是 (填离子符号)。
③步骤Ⅳ中,FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5mol·L-l。试判断所得FeCO3,固体是否混有Fe(OH)2: (填“是”或“否”),请通过简单计算说明理由 。
(已知: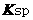 [Fe(OH)2] =4.9 xlO-17;
[Fe(OH)2] =4.9 xlO-17;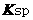 [FeCO3] =2.lxl0-11)
[FeCO3] =2.lxl0-11)
④写出在空气中煅烧FeCO3,制备高纯氧化铁的化学方程式 。
23.(14分)
X、Y、Z、Q、R5种短周期元素原子序数依次增大。化合物甲由X、Z、Q3种元素组成,常温下,0.1mol·L-l甲溶液的pH =13。工业上常用电解QR饱和溶液生产甲
请填写下列空白
(1)Q的原子结构示意图为 。
(2)常温下将R的单质通人甲溶液中,发生反应的离子方程式为 。
(3)①若Y与X组成的气体化合物乙在常温下遇XR气体时产生白烟,则乙的化学式为
;利用燃料电池原理:将X、Y的单质气体分别通人电池的两极,用质子导电陶瓷传递H+,可合成乙,该电池的负极反应式为 。
②若Y元素的单质能发生如右图所示转化,则Y元素是
 。已知:298K时,反应②生成1mol YZ2(g)时放
。已知:298K时,反应②生成1mol YZ2(g)时放
出热量283.O kJ·mol-1,反应④生成1mol YZ2(g)时
放出热量393.5 kJ·mol-1,反应③的热化学方程式为
。
12.将标准状况下2.24LCO2缓慢通入100mLmol·L-1NaOH溶液中(溶液体积变化忽略不计),充分反应后,下列关系正确的是
A.c( )>c(
)>c( )>c(
)>c(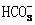 )
)
B.c( )+c(
)+c( )=c(
)=c(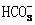 )+2c(
)+2c(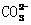 )+c(
)+c( )
)
C.c( )>c(
)>c(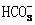 )>c(
)>c( )>c(
)>c( )
)
D.c(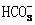 )+2c(
)+2c(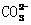 )+c(
)+c( )=1 mol·L-1
)=1 mol·L-1
第Ⅱ卷
必考部分
11.下列6种试剂:①烧碱溶液 ②金属钠
③浓硝酸 ④葡萄糖溶液 ⑤氯化铝溶液
⑥氨水,可以直接盛放在带磨口玻璃塞的无色试剂瓶的是
A.①和③ B.②和④ C.③和⑥ D.④和⑤
10.打开右图所示装置中的止水夹,一段时间后,可能观察的现象是
 A.烧杯中有气泡产生
A.烧杯中有气泡产生
B.试管内有黄绿色气体产生
C.铁丝网的表面产生绣迹
D.烧杯内溶液变红色
9.在密闭容器中,反应:CH4(g)+H20(g) CO(g)+3H2(g)
CO(g)+3H2(g)
 达到平衡。下列叙述不正确的是
达到平衡。下列叙述不正确的是
A.增加甲烷的量,上式中△H增大 B.增大水蒸气的量,可提高甲烷的转化率
C.升高温度,逆反应速率增大 D.增大体系压强,该反应的化学平衡常数不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com