
题目列表(包括答案和解析)
27、(16分)现有四种短周期元素X、Y、Z、W,其中:
①X、W原子的电子层数与最外层电子数之比分别为3:1和1:3
②Y原子是元素周期表中原子半径最小的
③Z是形成化合物种类最多的元素
回答下列问题:
(1)X元素在周期表中的位置是 。Y2W2晶体属于 晶体。
(2)上述四种元素中,只由一种元素的原子构成的离子共有五种,它们分别是
(填离子符号,)。
(3)向含1 mol Na2SiO3的溶液中缓慢通入2 mol的ZO2,反应的离子方程式是
。
反应后溶液中阴离子浓度由大到小的顺序是 。
(4)由Y、Z、W元素中的两种或三种可以组成多种分子,其中含有18个电子的分子是 (填化学式)。
(5)用KMnO4溶液可以通过滴定来测定Y2Z2W4溶液的物质的量浓度。向250.0 mL的Y2Z2W4溶液中加入50.00 mL 0.50 mol/L酸性KMnO4溶液恰好完全反应得到Mn2+,反应的离子方程式为 ,
则此种Y2Z2W4溶液的物质的量浓度是 mol/L。
26、(14分)铁是一种历史悠久、应用最广泛、用量最大的金属。某实验小组用铁粉进行如下实验。
(1)取少量纯铁粉与足量的稀硫酸反应,在不影响产生氢气总量的情况下,若要加快反应速率,可行的方法有(填序号) 。
①加热 ②滴加少量浓硝酸 ③滴加少量硫酸铜
(2)甲同学欲用少量纯铁粉与足量浓硫酸反应得到硫酸亚铁。同学们认为不论常温还是加热的条件下均不可行,理由是
。
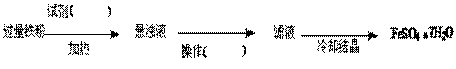 大家讨论后将上述方案做如下改进后可获得FeSO4·7H2O,请填写下列括号中的空白:
大家讨论后将上述方案做如下改进后可获得FeSO4·7H2O,请填写下列括号中的空白:
(3)乙同学在实验室中用m g未生锈的废铁屑(已除去表面的油污)与足量稀硫酸反应,准确测定反应生成氢气的体积,实验数据记录如下:
|
气体体积/mL |
10 |
20 |
30 |
|
所用时间/s |
30 |
85 |
165 |
若用每秒产生的气体体积(mL)表示该反应的速率,则30s至85s内该反应的速率为 。
若完全反应后将产生气体用于构成氢氧燃料电池,又用该电池电解饱和食盐水制得的氯气体积为V mL (已折算成标准状况),则该废铁屑中铁的质量分数为(用含m、V的代数式表示) 。
若实验操作无误,但测得铁的质量分数总是大于实际值,原因可能是
13、在温度恒定时,在1L密闭容器中存在着H2、I2、HI三种物质,下列图象均是表示此反应的有关量值与时间或外界条件时关系的,下列有关叙述错误的是( )
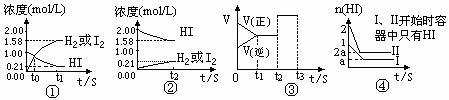
A.图①中,t0时三种物质的物质的量相等
B.图②中逆反应为H2+I2→2HI
C.图③中t2改变条件后容积内各成分百分含量均会发生变化
D.图④表明HI起始数量的不同,不会改变平衡体系的各成份百分含量
第Ⅱ卷(非选择题,共174分)
12、下列叙述正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:
c[(NH4)2SO4] < c(NH4Cl) c[(NH4)2< Fe(SO4)2]
B.无色透明的酸性溶液中,Cu2+、K+、SO42-、NO3- 能大量共存
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1
D.NaHCO3溶液中:c(H+) + c(H2CO3)=c(CO32-) + c(OH-)
11、下列离子方程式正确的是( )
A.碳酸钙与醋酸反应:CaCO3+2H+===Ca2++CO2↑+H2O
B.向AgNO3溶液中滴加过量氨水Ag++NH3·H2O =AgOH↓+NH4+
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O 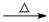 2C6H5OH+CO
2C6H5OH+CO
D.甲醛溶液与足量的银氨溶液共热
HCHO+4[Ag(NH3)2]++4OH-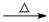 CO
CO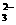 +2NH
+2NH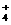 +4Ag↓+6NH3+2H2O
+4Ag↓+6NH3+2H2O
10、 下列叙述正确的是
下列叙述正确的是
①装置甲可防止铁钉生锈 ②装置乙可除去乙烯中混有的乙炔
③装置丙可验证HCl气体在水中的溶解性 ④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、HCl、NO2等气体
A.①③⑤ B.③④ C.①②④ D.③⑤
9、酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2C7酸性水溶液乙醇迅速生成蓝绿色Cr3+。下列对乙醇的描述与此测定原理有关的是( )
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性 ④乙醇是烃的含氧化合物
A.②④ B.②③ C.①③ D.①④
8、NA为阿伏加德罗常数,下列说法正确的是( )
A.常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1NA
B.16g 氧气和16g 臭氧含有的电子总数均为8NA
C.1 mol乙炔分子中含3NA个碳碳叁键
D.22.4LCH4和CH3Cl的混合物所含有的分子数目为NA
7、下列有关表述不正确的是( )
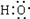 A、-OH与
组成元素相同,含有的电子数也相同
A、-OH与
组成元素相同,含有的电子数也相同
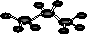
B、丙烷的分子结构模型示意图:
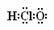
C、次氯酸的电子式为
D、熔化时NaHSO4的电离方程式为:NaHSO4=Na++HSO4-
6、2010年3月3日开幕的全国政协十一届三次会议的一号提案为“关于推动我国低碳经济发展的提案”。在全球气候变暖的背景下,以低能耗、低污染为基础的“低碳经济”成为发展趋向。请判断以下措施中与上述要求相违背的是( )
A.持续大规模开展退耕还林和植树造林活动
B.农作物收获后,就地焚烧秸秆,增加土壤中的钾肥
C.发展羰基合成等工艺技术,利用二氧化碳生产精细化工产品
D.大力发展以煤气化为龙头,以一碳化工技术为基础的新一代煤化工业
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com