
题目列表(包括答案和解析)
6.化学与科技、化学与生活息息相关。下列说法正确的高*考#资^源*网是
A.2009年我国起征燃油税,这是政府推进节能减排的高*考#资^源*网一项新举措。石油工业通过石油分馏得到汽油,主要发生了化学变化
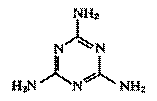 B.2008年诺贝尔化学奖授予研究绿色荧光蛋白的高*考#资^源*网科学家,利用丁达尔效应不能将蛋白质溶液和葡萄糖溶液区分开
B.2008年诺贝尔化学奖授予研究绿色荧光蛋白的高*考#资^源*网科学家,利用丁达尔效应不能将蛋白质溶液和葡萄糖溶液区分开
C.广为人知的高*考#资^源*网奶粉事件中的高*考#资^源*网罪魁祸首为三聚氰胺(结构如图),其摩尔质量为126g·mol-1
D.2010年4月支援青海玉树地震灾区的高*考#资^源*网生活用品中的高*考#资^源*网食醋、纯碱、食盐,其对应的高*考#资^源*网的高*考#资^源*网主要化学物质分别属于酸、碱、盐
28、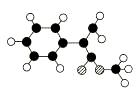 (14分)A是生产某新型工程塑料的基础原料之一,由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键)。
(14分)A是生产某新型工程塑料的基础原料之一,由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键)。
(1) 根据分子结构模型写出A的分子式____________ ,A分子中至少有________个碳原子一定共平面,A的核磁共振氢谱有_______个吸收峰。
 (2)以
为主要原理合成A的路线如下:
(2)以
为主要原理合成A的路线如下:
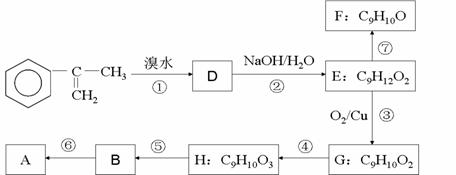
(a)A的合成路线中属于氧化反应的有__________ (填序号)
(b)H的结构简式为___________
(c)写出反应⑥的化学方程式(注明必要的条件)
______________________________________________________________________________________
(d)已知反应⑦为消去反应,有同学试图用酸性KMnO4溶液将F直接氧化成B,你认为该想法能否实现?若能,写出反应的化学方程式,若不能请说明原因。
_________________________________________________________________________________________
(e)G的某同分异构体,苯环上只有一个侧链,且能发生银镜反应和水解反应,写出其可能的结构简式_____________________________________________________________
化 学
题号:15
“化学与生活”模块(10分)
市场销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配 料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
20~50mg/kg |
|
分装时期 |
|
|
分装企业 |
|
⑴碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处) KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
⑵上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是 。
⑶已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反
应完全。
①判断c中反应恰好完全依据的现象是 。
②根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示) mg/kg。
题号:16
“化学与技术”模块(10分)
材料的加工处理在工业生产中用途很多,如金属的表面处理、腐蚀加工技术等。现利用有关知识回答下面的问题。
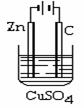 (1)铝的阳极氧化:在进行电解以前,要对铝电极进行表面处理,是将铝片浸入热的16%NaOH溶液中半分钟左右,目的是
,反应的离子方程式为 。铝的阳极氧化时,铝与电源的 极(填写正、负极)相连。
(1)铝的阳极氧化:在进行电解以前,要对铝电极进行表面处理,是将铝片浸入热的16%NaOH溶液中半分钟左右,目的是
,反应的离子方程式为 。铝的阳极氧化时,铝与电源的 极(填写正、负极)相连。
(2)电解原理的运用:在右图装置中,溶液的体积为100mL,开始时电解质溶液的浓度为0.1mol/L,工作一段时间后导线上通过0.001mol电子。若不考虑盐的水解和溶液体积的变化,则电解后溶液的pH值为____________。
(3)电镀是运用电解原理,在金属表面形成一薄层有抗腐蚀、抗磨损能力的金属镀膜的过程。例如:在铜片上电镀银时,电解原理是:采用AgNO3溶液为电解质,用 作阳极,阴极的电极反应式为 。而在实际的电镀工艺中,要求金属在镀件上的析出速率得到控制,使析出的镀层厚度均匀、光滑致密、与底层金属的附着力强。所以在铁件上电镀铜时,实际使用的电镀液是 。
A、FeCl2 B、CuCl2 C、K6[Cu(P2O7)2] D、CuSO4
26.(15分)为减小和消除由于操作原因CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:

(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947 kJ的热量,试写出合成塔中发生反应的热化学方程式是 。
(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:
CH3OH + H2O - 6e- ==== CO2 + 6H+
则正极发生的反应是 ;放电时,H+移向电池的 (填“正”或“负”)极。
(3)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3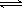 HCO3-+H+ 的平衡常数K =
。(已知:10-5.6=2.5×10-6)
HCO3-+H+ 的平衡常数K =
。(已知:10-5.6=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-) (填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。
(5)小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp分别为4.96×10-9、2.58×10-9。小李应该选用的试剂是___________________。 27、(12分)A-G为中学常见的化合物,它们之间有如图
 所示的转化关系(反应条件及部分产物已略去)。A为绿色
所示的转化关系(反应条件及部分产物已略去)。A为绿色
粉末,含H、C、O、Cu四种元素。常温下D为无色无味
气体,B为黑色粉末,E能发生银镜反应。请回答:
(1)D跟G反应的化学方程式为_____________________________________;
(2)F中一定含有的官能团的名称为_______________________;
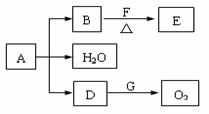
(3)某课外小组同学设计了上述实验装置,通过测定某些装置中试剂的质量变化,探究A中各元素的质量关系。
① 为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
② 向装置中鼓入空气的目的是_________________________________________________________;
丙装置中药品的名称为_______________________________,实验时,该药品未见明显变化,证明_______________________________________________________________________________;
③ 如何判断A已完全分解?____________________________________________________________。
④ 更精确的测定得出如下数据:A受热后完全分解,固体由8.0 g变为6.0 g,装置乙增重0.90 g。写出A的化学式(表示为碱式盐):__________________________________________
25.(15分)有关元素X、Y、Z、W的信息如下
|
元素 |
有关信息 |
|
X |
所在主族序数与所在周期序数之差为4 |
|
Y |
最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
|
Z |
单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
|
W |
地壳中含量最高的金属元素 |
请回答下列问题:
(1) W的单质与Y的最高价氧化物对应的水化物反应的离子方程式为_______________。
(2) 铜片、碳棒和ZX3溶液组成原电池,写出正极发生的电极反应方程式
_______________________________________________ 。
(3) 向淀粉碘化钾溶液中滴加几滴ZX3的浓溶液,现象为_____________________,相关反应的离子方程式为_______________________________。
(4) 以上述所得WX3溶液为原料制取无水WX3,先制得WX3·6H2O晶体,主要操作包括__________________________,在_____________________条件下加热WX3·6H2O晶体,能进一步制取无水WX3,其原因是(结合离子方程式简要说明)_______________________________。
13.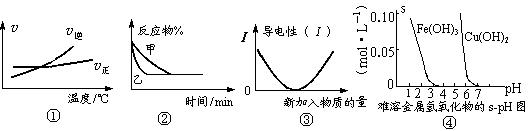 化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
A.根据图①可判断可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
12.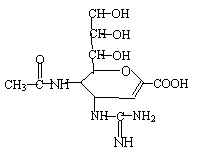 “甲型H1N1”流感疫情已构成“具有国际影响的公共卫生紧急事态”。已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性。其分子结构如右图:下列说法正确的是
“甲型H1N1”流感疫情已构成“具有国际影响的公共卫生紧急事态”。已知扎那米韦是流感病毒神经氨酸酶抑制剂,其对流感病毒的抑制是以慢结合的方式进行的,具有高度特异性。其分子结构如右图:下列说法正确的是
A.该物质的分子式为C12H19N4O7
B.在一定条件下,该物质可以发生消去、加成、取代等反应
C.1mol该物质与NaOH溶液反应,可以消耗4mol NaOH
D.该物质能使溴水或高锰酸钾溶液褪色,能与FeCl3溶液发生显色反应
11.关于下列图示的说法中正确的是
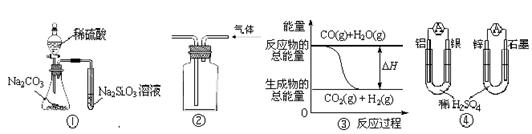
A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.图③表示可逆反应“CO(g)+H2O(g) CO2(g)+H2(g)”中的ΔH大于0
CO2(g)+H2(g)”中的ΔH大于0
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
10.在下列给定条件的溶液中,一定能大量共存的离子组是
A.在使pH试纸变红的溶液中:Fe2+、Na+、SO42-、ClO-
B.由水电离的c(OH-)=10-14mol·L-1 的溶液:CH3COO-、SO42-、Na+、K+
C. 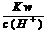 =0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
D.含有大量NO3-的溶液:SO42-、Fe2+、H+、Cl-
9.下列实验设计能完成或实验结论合理的是
A.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化
B.某溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,说明该溶液中有Ca2+
C.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
D.用核磁共振氢谱图鉴别乙醇和乙酸
8.2009年12月7日-18日在丹麦首都哥本哈根召开了世界气候大会,商讨《京都议定书》一期承诺到期后的后续方案,即2012年至2020年的全球减排协议。大会倡导“节能减排” 和“低碳经济”。下列做法不符合这一理念的是
A.推广利用二氧化碳与环氧丙烷和琥珀酸酐的三元共聚物的生物降解材料
B.使用填埋法处理未经分类的生活垃圾
C.推广煤的干馏、气化、液化技术,提供清洁、高效燃料和基础化工原料
D.发展水电,开发新能源,如核能、太阳能、风能等,减少对化石能源的依赖
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com