
题目列表(包括答案和解析)
6.将l1.2g的Mg-Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体(假定产生的气体全部逸出)。再向所得溶液中加入足量的NaOH溶液,产生21.4g沉淀。根据题意推断气体X的成分可能是 ( )
A.0.3mol NO2和0.3mol NO
B.0.1mol NO、0.2mol NO2 和0.05mol N2O4[来源:高&考%资(源#网]
C.0.2mol NO2和0.1mol N2O4
D.0.6mol NO
第Ⅱ卷
本卷共4题。共64分
5.设NA代表阿伏加德罗常数的值,下列叙述正确的是 ( )
A.0.1mol铁粉与足量的高温水蒸气作用,生成的H2分子数为0.1NA
B.室温,IL pH=4的醋酸溶液中,由水电离产生的H+为l0-4NA
C.0.1 mol甲基(-CH3)所含质子数为9NA
D.标准状况下,22.4LCH2Cl2中含有的Cl原子数为2NA
4.镁燃料电池以镁合金作为电池的一极,另一极充入过氧化氢,电解质溶液是酸化的氯化钠溶液,放电时总反应:Mg+2H++H2O2 Mg2++2H2O。关于该电池说法正确的是( )
A.放电时H+在正极反应得电子
B.正极反应式为:H2O2+2e- 2OH-
C.镁合金为屯池负极,发生氧化反应
D.电池工作时,电解质溶液的pH降低
3.下列叙述不正确的是 ( )
A.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B.一定温度下,IL lmol/L的氨水与2L 0.5moFL的氨水中,n(NH4+)前者多
C.相同体积、相同物质的量浓度的盐酸、醋酸,稀释相同倍数后,溶液的pH:盐酸<醋酸
D.0.2mol/L的一元酸HX与0.1mol/L的KOH溶液等体积混合所得溶液中,一定有:a(H+)+c(K+)=c(OH-)+c(X-)
2.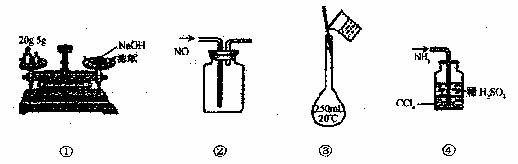 下列各图所示的实验方法正确的是 ( )
下列各图所示的实验方法正确的是 ( )
A.①称量氢氧化钠固体 B.②收集NO气体
C.③配制100mL 0.10mol/L 盐酸 D.④吸收多余的NH3
1.下列说法正确的是 ( )
A.在使用浓硝酸时,如不慎溅到皮肤上,皮肤会显黄色,是由于浓硝酸与蛋白质发生了颜色反应
B.酸性食物指的是在味觉上具有酸味的食物
C.光导纤维、玻璃纤维、合成纤维都属于高分子化合物
D.解决“白色污染”最有效的办法是直接焚烧,可回收热能用于加热或发电等
30.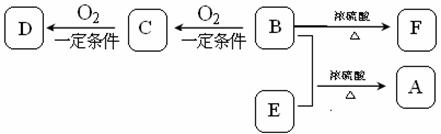 (15分)有机物A(C13H18O2)具有香味,可用作香皂、洗发香波的芳香剂。A可通过下图所示的转化关系而制得。
(15分)有机物A(C13H18O2)具有香味,可用作香皂、洗发香波的芳香剂。A可通过下图所示的转化关系而制得。
已知:
①B属于芳香族化合物,相对分子质量大于100,小于130,其中含氧质量分数为0.131;
②D、E具有相同官能团。E分子烃基k@s^5*u上的一氯取代物只有一种;
③F可以使溴的四氯化碳溶液褪色。
请回答下列问题:
(1)B的分子式为 ;B在k@s^5*u上图转化中所发生的反应类型有 。
(2)F的名称是 ,C发生银镜反应的化学方程式是 。
(3)D的同分异构体有多种,写出符合下列条件的所有物质的结构简式
a.属于芳香族化合物且苯环k@s^5*u上的一氯代物有两种;b.含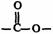 基团。
基团。
(4)B和E反应生成A的化学方程式为 。
29. (15分)某实验小组欲测定KMnO4的分解率α,但加热前忘记称量KMnO4的质量。面对此情况,甲同学采用下述方法:在加热时,利用浓盐酸与KMnO4受热部分分解后所得的固体混合物反应产生的Cl2被碱石灰吸收,通过碱石灰增重来计算KMnO4的分解率α。(与热的浓盐酸反应时,固体混合物中的Mn元素均被还原成Mn2+)
(15分)某实验小组欲测定KMnO4的分解率α,但加热前忘记称量KMnO4的质量。面对此情况,甲同学采用下述方法:在加热时,利用浓盐酸与KMnO4受热部分分解后所得的固体混合物反应产生的Cl2被碱石灰吸收,通过碱石灰增重来计算KMnO4的分解率α。(与热的浓盐酸反应时,固体混合物中的Mn元素均被还原成Mn2+)
取KMnO4受热部分分解后所得的固体混合物mg进行实验,请从k@s^5*u上图中选用所需的仪器(可重复选用)组成一套反应装置,其它固、液试剂自选。(其中某些连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置、打气筒等均略去)
(1)在反应发生前,为了消除装置内空气中酸性气体的影响,须用打气筒向装置内鼓入一定量的空气。请你在下表中填写完成本实验时各装置的连接次序及药品。
|
各装置连接次序 |
|
A |
|
|
C |
C |
|
对应的药品 |
|
d:浓盐酸 e:固体混合物 |
|
|
碱石灰 |
碱石灰 |
(2)k@s^5*u上述高锰酸钾受热部分分解后所得固体混合物中K2MnO4与MnO2物质的量之比是 。
(3)当A装置内反应结束后,关闭分液漏斗活塞,打开止水夹k,再一次用打气筒向装置内鼓入一定量空气,其目的是 。
(4)若测得碱石灰增重ng。为了计算KMnO4的分解率α,该同学采用方法如下:设原mg的固体混合物中KMnO4及MnO2的物质的量分别为x、y,依据实验数据m及n,可列出三个含x、y、α的等式,请你写出这三个等式。(注意:等式中不用带单位)
仅含m、x、y的等式①:m= 。
仅含 n、x、y的等式②:n= 。
仅含α、x、y的等式③:α= 。
(5)另一同学设计更为简单的方法(无须化学反应)也可测定KMnO4的分解率α。
该同学的方法是:称取一定量KMnO4受热部分分解后所得的固体混合物,置于盛有适量蒸馏水的烧杯中,充分搅拌,再进行“一系列实验操作”并记录实验数据,最后经计算,即可得出KMnO4的分解率α。该同学的“一系列实验操作”是指 。
28. (15分)已知在某密闭容器中进行的反应a A
(g)
(15分)已知在某密闭容器中进行的反应a A
(g)  b B (g)+ c C (g),(其中a、
b、c分别为方程式中的物质计量数),某物理量Y随时间(t)变化的情况如右图所示(X1、X2表示不同温度或压强),请回答下列问题:
b B (g)+ c C (g),(其中a、
b、c分别为方程式中的物质计量数),某物理量Y随时间(t)变化的情况如右图所示(X1、X2表示不同温度或压强),请回答下列问题:
(1)当X1、X2分别表示不同的温度状况时,Y可代表生成物C在平衡时混合物中的质量分数, 则该反应的正反应是 反应(填“放热”或“吸热”);
(2)当X1、X2分别表示不同的压强状况时,Y可代表反应物A的转化率,则X1 X2(选填“>”或“<”或“=”);a、 b 、c三者之间的关系为 a (b+c)(填“>”或“<”或“=”)
(3)将 4mol A、3mol B、2mol C充入该反应容器中,在温度为T,压强为P的条件下达平衡后,测得A、B、C的物质的量分别是2mol A、5mol B、3mol C,则a、b、c的最简整数比为 ;此时A的转化率为 。若将最初充入该反应容器中的各物质的物质的量变为5mol A、2mol B、1.5mol C,也在温度为T,压强为P的条件下建立平衡,此时容器中的C在混合气体中的体积分数为30%,则此时A的转化率为 。
(4)将 4mol A、3mol B、2mol C充入该反应容器中并达平衡,下列措施能提高物质B在平衡混合气体中体积分数的是 (填写序号)
①增加B的物质的量 ②加入合适的催化剂
③增加A的物质的量 ④降低温度
27.(15分)已知X、Y、Z为三种由短周期元素构成的粒子,每摩粒子都有10mol电子,其结构特点如下:
|
|
X |
Y |
Z |
|
原子核数 |
单核 |
四核 |
双核 |
|
粒子的电荷数 |
1个单位正电荷 |
0 |
1个单位负电荷 |
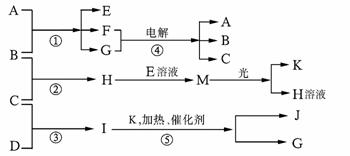 现有A、B、C、D、E、F、G、H、I、J、K等物质,它们之间的相互反应转化关系如下图所示:
现有A、B、C、D、E、F、G、H、I、J、K等物质,它们之间的相互反应转化关系如下图所示:
已知物质A由X、Z构成, B、C、D、K都是单质,G为无色液体,I的水溶液呈碱性,反应①-⑤都是用于工业生产的反应,请回答下列问题:
(1) A的电子式为 ;D的结构式为 。
(2)物质B的组成元素在元素周期表中的位置是 。
(3)反应①的化学方程式为 。
反应④离子方程式为 。
(4)H和I反应的生成物的水溶液呈酸性,其原因是 (用一个离子反应方程式表示)
(5)已知每生成1mol I放出46.0kJ的热量,则反应③的热化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com