
题目列表(包括答案和解析)
18.(1)A ;B ;C 。
(2) A、B转化为D、E 。
(3) A与足量稀硝酸 。
17.写作 和 。
,
。
16.第一种情况:一定有 离子,可能有 离子;
第二种情况:一定有 离子,可能有 离子。
请将答案填涂在答题卡上!
22.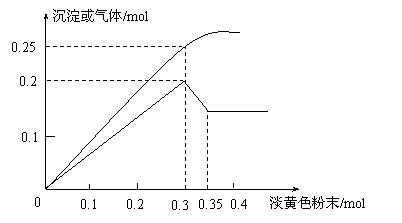 有一无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示。请回答:
有一无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示。请回答:
(1)淡黄色粉末为_____________(填名称),溶液中肯定没有____________离子。
(2)溶液中存在的各溶质阳离子的物质的量分别是_________________________。
(3)当加入0.3mol淡黄色粉末时,生成气体成分是 , 物质的量之比是 。
(4)①淡黄色粉末与水反应的化学方程式为__________________________。
②沉淀部分减少时的离子方程式为__________________________________。
21.欲在室温和1.01×105 Pa条件下测定镁的相对原子质量。请利用下图给定的仪器中选择合适的仪器组成一套实验装置(每仪器只允许用一次)。

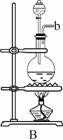
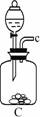
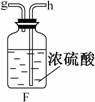



请回答下列问题:
(1)假设气流方向为左→右,则所选各仪器的接口连接顺序为(用小写字母填写):
_________________________________。
(2)连接好仪器后,要进行的操作有以下几步:
①待反应容器中的物质恢复至室温时,测量出气体体积折合到标准状况下为V mL;
②擦掉镁条表面的氧化膜,将其置于天平上称量(假定其质量为m g);
③检查各装置的气密性;
④往反应容器内加入某稀酸,至镁条不再溶解。
上述几步操作的先后顺序是 。
(3)根据实验数据可算出镁的相对原子质量,其数学表达式为____________________。
(4)若未将反应容器冷却至室温就测量气体体积,这将会使所测镁的相对原子质量数据(填“偏高”、“偏低”、“无影响”)_______________。
(5)若未擦净镁条表面氧化膜就进行实验,这将会使所测镁的相对原子质量数据(填“偏高”、“偏低”、“无影响”)__________________。
20.从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:
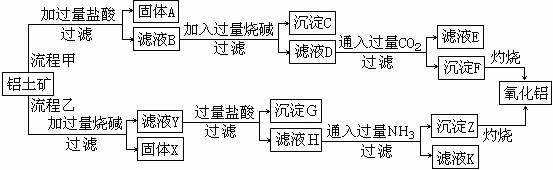
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为 。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为 。
(3)验证滤液B含Fe3+,可取少量滤液并加入 (填试剂名称)。
(4)滤液E中溶质的主要成份是 (填化学式),写出该物质的一种具体用途 。
(5)已知298 K时,Mg(OH)2的容度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+) = 。
19.提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
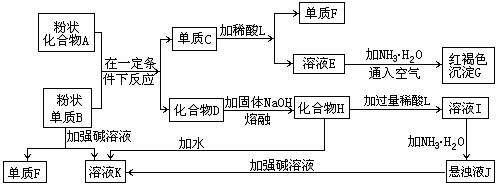
(1)单质F是_____________________。
(2)由E生成G的离子反应方程式(或化学方程式)________________________。
(3)溶液I中所含金属离子是_____________________。
(4)由C转化为E、F若改用浓酸,则不能选用的浓酸是(写分子式)______________。
18.A、C、E是中学化学中常见的单质,A是固体,C、E是无色无味的气体,D是黑色晶体,它们之间的转化关系如下图所示。
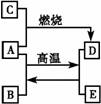
(1)写出A、B、C的化学式:
A___________________;B_________________;C______________。
(2)写出A、B转化为D、E的化学方程式_____________________________________。
(3)写出A与足量稀硝酸反应的离子方程式___________________________________。
17.若把Fe3O4看成“混合氧化物”时可以写成FeO•Fe2O3,若看成一种盐时又可以写成Fe(FeO2)2。根据化合价规则和这种书写方法,Pb3O4可以分别写作
和 。等物质的量的Fe3O4和Pb3O4分别和浓盐酸反应时,所消耗HCl的物质的量相等,不同的是,高价的铅能将HCl氧化而放出氯气。试写出Fe3O4、Pb3O4分别和浓盐酸反应的化学方程式 ,
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com