
题目列表(包括答案和解析)
4、下列物质反应有关现象描述错误的是( )
A.氢气在氯气中燃烧--苍白色火焰
B.钠在空气中燃烧--黄色火焰,且有白色固体生成
C.硫在氧气中燃烧--蓝紫色火焰
D.铜在氯气中燃烧--棕黄色的烟
3.下列操作正确的是( )
A. 向盛水的烧杯中投入小拇指大小的钠块,观察现象
B.将钠保存在汽油中
C.将一小块钠放在石棉网上加热,观察现象
D.用手掰开一块金属钠,观察钠的颜色
2、查阅资料发现,金属钠不仅能跟氧气和水反应,还能跟多种其他物质发生反应,其中包括与酒精在常温下反应。要研究金属钠跟酒精反应的性质以及它与金属钠跟水反应的异同点,下列的研究方法中用不到的是( )
A.实验法 B.观察法
C.分类法 D.比较法
1、请你运用所学的化学知识判断,下列有关化学观念的叙述错误的是( )
A.几千万年前地球上一条恐龙体内的某个原子可能在你的身体里
B.用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒)
C.一定条件下,金属钠可成为绝缘体
D.一定条件下,水在20℃时能凝固成固体
29.(13分)已知:一个碳原子上连有两个羟基时不稳定,易发生下列转化:
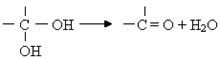
某烃A的蒸气密度是相同状况下氢气的53倍,烃A不能使溴的CCl4溶液褪色,但能使酸性KMnO4溶液褪色。氢原子核磁共振谱图表明A有2个吸收峰,强度之比为3∶2,B只有1
个吸收峰,D有2个吸收峰,G为环状结构。A可以发生如下图所示的一系列变化(生成的其它无机物均未写出) 请回答下列问题:
请回答下列问题:
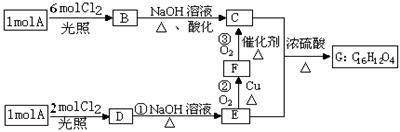
(1)A的分子式是__。
(2)指出下列反应的反应类型:①_、。
(3)写出B、G的结构简式: G_。
(4)写出下列反应的化学反应方程式:反应②_;
C和E还能生成高分子化合物,请写出其反应的化学方程式_。
(5)写出满足下列条件的E的所有同分异构体的结构简式(E不必再写): _。
①遇FeCl3溶液显紫色;②能发生消去反应生成碳碳双键
福建莆田十中第七次月考试卷理科综合测试卷
30.[化学--物质结构与性质](13分)
短周期元素X、Y、Z、W原子序数依次增大。已知W与X原子最外层都只有1个S电子,二者电子层数之差为2;Y原子最外层S电子与P电子数相等,其电子层数与内层电子数相等;Z原子S电子与P电子数相等
(1)Z原子的电子排布式为 。
(2)X与Y两种元素构成的最简单的化合物分子的空间构型是 结构,这种结构的分子中的中心原子一般采用 杂化轨道形成化学键。由X和Y形成的化合物Y2X2分子的共价键有 个σ键和 个π键。
(3)Z与W以原子个数比1:1形成的化合物的化学式是 ,该化合物固态时属于 晶体,形成该晶体的化学键有 。 K^S*5U.C#O
(4)X与Z形成的化合物X2Z的结构式为 ,该物质的沸点比较高,其主要原因是 。
28.(15分)聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。现用一定质量的铁的氧化物(如下图)为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe 2+。实验步骤如下:
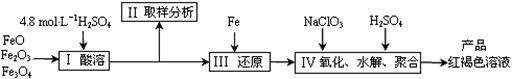
(1)实验室用18.4 mol·L-1的浓硫酸配制250mL4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种带有刻度的移液管)外,还需_▲_。
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是_▲_。 K^S*5U.C#O
A.控制溶液中Fe2+与Fe3+含量比 B.确定下一步还原所需铁的量
C.确定氧化Fe2+所需NaClO3的量 D.确保铁的氧化物酸溶完全
(3)写出步骤Ⅳ中用NaClO3氧化时的离子方程式_▲_(提示:ClO3-转化为Cl-);
已知1mol HNO3的价格为0.16元,1mol NaClO3的价格为0.45元,评价用HNO3代替NaClO3作为氧化剂的利弊,利是_▲_,弊是_▲_。
(4)为了分析产品聚合硫酸铁溶液中SO42-与Fe3+ 物质的量之比,有人设计了以下操作:
(a)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤、洗涤、干燥后,称重,其质量为m g。
(b)另取25mL聚合硫酸铁溶液,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL,用KMnO4酸性溶液滴定,到达终点时用去0.1000 mol/L KMnO4标准溶液VmL。反应的离子方程式为:5Fe2+ + MnO4-+ 8H+ = 5Fe3+ + Mn2+ + 4H2O
回答下列问题:
①判断(a)步骤溶液中SO42-离子已沉淀完全的方法是_▲_;
②在(b)步骤中判断达到终点的现象是_▲_;
③聚合硫酸铁中SO42-与Fe3+的物质的量之比为_▲_(用含m、V的代数式表示)。
24.(15分)TiO2在工业生产和日常生活中有重要用途。 K^S*5U.C#O
I、工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
 其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:_________(填“需要”或“不需要”)
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式。答:

II、TiO2可通过下述两种方法制备金属钛:
方法一是电解TiO2来获得Ti(同时产生O2):将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。 K^S*5U.C#O
(3)阴极反应的电极反应式为___________________________________。
(4)电解过程中需定期向电解槽池中加入碳块的原因是______________________。
(5)方法二是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:TiO2 (s) +2Cl2
(g)  TiCl4(l) + O2 (g) K^S*5U.C#O
TiCl4(l) + O2 (g) K^S*5U.C#O
△H = +151 kJ·mol-1
所以不能直接由 TiO2 和 Cl2 反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行
从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因。
答:____________________________________________________________。
23.(16分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
217 |
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据表回答下列问题:
(1)碲的化合价可能有_________________
(2)氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为_______________________________________
(3)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
____A12Te3+_____( ) 一____A1(OH)3↓+____H2Te↑
 (4)已知在常温下,H2和S反应生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式:_______________________
__________。
(4)已知在常温下,H2和S反应生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式:_______________________
__________。
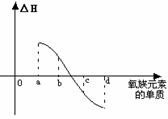
(5)右图所示为上述表格中氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,△H为相同物质的量的单质与H2反应的反应热。则:b代表________________,d代表_____________(均写单质名称)。
12.已知,同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则以下离子方程式错误的是( )
A. Cu2+ + H2S =CuS↓ + 2H+
B.Mg2+ + 2HCO3-+ 2Ca2+ + 4OH- =Mg(OH)2↓+ 2CaCO3↓+ 2H2O
C. Zn2+ + S2-+ 2H2O=Zn(OH) 2↓ + H2S↑
D.FeS + 2H+=Fe2+ + H2S↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com