
题目列表(包括答案和解析)
25.(14分)A、B、C、D、E、F六种短周期元素,原子序数依次增大,其中B、C、D处于同一周期,A与E、D与F分别在同一主族,A、E两元素的原子序数之和是D、F两元素原子序数之和的一半,也是B元素的原子核内质子数的两倍。又知,这六种元素中,三种元素各自形成的常见单质在常温常压下呈气态,而另三种元素的常见单质呈固态,请回答下列问题:
(1)以上元素中,形成的单质既有原子晶体又有分子晶体的元素是 (写元素名称)
(2)写出一个只涉及上述非金属元素的置换反应的化学方程式
(3)化合物A2D的沸点比化合物A2F高的原因是 。
(4)以上A、C、D三种元素以原子个数4:2:3组成的盐,其水溶液中各离子浓度由大到小顺序为 ,含有元素C的各微粒的浓度之间满足的数学关系式是 。
(5)甲、乙两种化合物均由A、B、D、E四种元素组成,其中A、B、E三种原子个数之比都为1:1:1,甲是无机盐,乙是有机盐,甲的相对分子质量比乙大,两种物质的水溶液都显碱性。则甲的化学式为 ,乙的摩尔质量为 ;
乙溶液显碱性的原因是 (用离子方程式表示。)
13.25℃时,下列溶液中微粒的物质的量浓度关系正确的是…………………( )
A.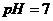 的
的 与
与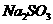 混合溶液中:
混合溶液中: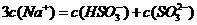
B.0.1mol·L-1的KHA溶液,其PH=10:C(K+)>C(OH-)>C(HA-)
C.20mL 0.1mol·L-1醋酸钠溶液与10mL 0.1mol·L-1盐酸混合后的溶液中:
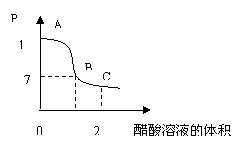
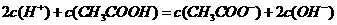
D.在25mL 0.1 mol·L-1 溶液中逐
溶液中逐
滴加入0.2mol·L-1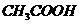 溶液,溶液pH
溶液,溶液pH
变化如右图所示,在A、B间任一点,溶液中一
定都存在下列关系:
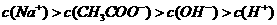
12.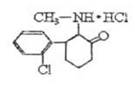 “K”粉,医学上称氯胺酮,属于静脉全麻药品,具有一定的精神依赖性。因其物理形状通常为白色粉末,故称“K”粉。目前,该药品已被我国药监部门列为第二类精神药品管理。其结构如右图所示。下列说法正确的是………………………………………( )
“K”粉,医学上称氯胺酮,属于静脉全麻药品,具有一定的精神依赖性。因其物理形状通常为白色粉末,故称“K”粉。目前,该药品已被我国药监部门列为第二类精神药品管理。其结构如右图所示。下列说法正确的是………………………………………( )
A.“K”粉的化学式为C13H16NOCl2
B.1mol“K”粉在一定条件下可与4molH2发生加成反应
C.“K”粉属于脂肪族化合物
D.“K”粉不可能与氢氧化钠溶液发生反应
11.已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得PH=13.0,则下列说法不正确的是…( )
A.所得溶液中的c(H+)=1.0×10-13mol·L-1
B.所得溶液中由水电离产生的c(OH-)=1.0×10-13mol·L-1
C.所加的烧碱溶液PH=13.0
D.所得溶液中的c(Mg2+)=5.6×10-10mol·L-1
10.下列离子方程式中书写正确的是………………………………………………………( )
A.在碳酸氢铵稀溶液中加入足量的氢氧化钠稀溶液:NH4++H++2OH-=NH3·H2O+H2O
B.等物质的量浓度的氢氧化钡溶液与稀硫酸等体积混合:Ba2++SO42-=BaSO4↓
C.稀硝酸除银镜反应中试管内壁附着的银镜:3Ag+4H++NO3-=3Ag++NO↑+2H2O
D.氢氧化铁胶体中通入碘化氢气体:Fe(OH)3+3H+=Fe3++3H2O
9.设NA表示阿伏伽德罗常数,下列说法正确的是………………………………………( )
A.若硫酸铝溶液中Al3+的数目NA,则SO42-的数目大于1.5NA
B.0.2mol铁在0.2mol氯气中充分燃烧,转移的电子数为0.6NA
C.14n g分子式为CnH2nO的有机物中含有羧基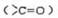 的数目为NA
的数目为NA
D.标准状况下,2.24L的苯中含有0.3NA个碳碳双键
8.下列说法不正确的是………………………………………………………( )
A.纸层析通常把不与水混溶的有机溶剂作为流动相
B.减压过滤是为了加快过滤速度,得到较大颗粒的晶体
C.催化剂参与化学反应,改变了反应的活化能
D.制摩尔盐时用酒精洗涤产品,而在制阿司匹林时用水洗涤产品
7.下列行为中不符合“促进低碳经济”宗旨的是……………………………………( )
A.发展水电,开发新能源,如核能、太阳能、风能等,减少对矿物能源的依赖
B.限制化学发展,关停化工企业,消除污染源头
C.推广煤的干馏、气化、液化技术,提供清洁、高效燃料和基础化工原料,挖掘使用价值
D.推广利用微生物发酵技术,将植物桔杆、动物粪便等制成沼气以替代液化石油气
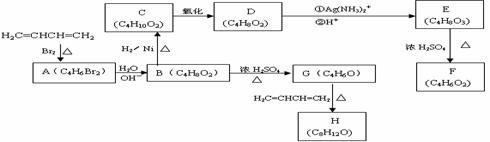
14.A-H均为有机化合物,它们之间的转化如下图所示:
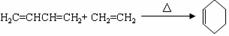 提示:已知反应
提示:已知反应
实验表明:①D既能发生银镜反应,又能与金属钠反应放出氢气;② F不能使溴水褪色;③G能使溴的四氯化碳溶液褪色。请根据以上信息回答下列问题:
⑴A的结构简式为 ,由A生成B的反应类型是 反应;
⑵D的结构简式为 。
⑶由E生成F的化学方程式为 ,与E具有相同官能团的E的同分异构体还有 (写出结构简式,只要写2个);
⑷G的结构简式为 ;
⑸由G生成H的化学方程式为 。
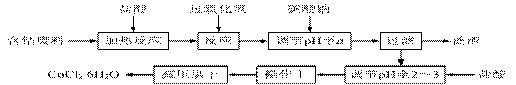
13.CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
7.6 |
3.4 |
|
完全沉淀 |
4.1 |
9.7 |
9.2 |
5.2 |
请回答下列问题:
⑴在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为 。
⑵加入碳酸钠调节pH至a,a的范围是 。
⑶操作Ⅰ包含3个基本实验操作,它们是 和过滤。
⑷制得的CoCl2·6H2O需减压烘干的原因是 。
⑸为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。
⑹在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,采用的方法是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com