
题目列表(包括答案和解析)
6、科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机酸转化成氢气,氢气进入
以磷酸为电解质的燃料电池发电。电池负极反应为
A.H2+2OH- 2H2O+2e- B.O2+4H++4e- 2H2O
C.H2 2H++2e- D.O2+2H2O+4e-
4OH-
5、用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量硫酸铜溶液 D.不用铁片,改用铁粉
4、下列各选项中分子中各原子均达到8电子稳定结构的是
A.SiO2 B.SICl4 C.P2O5 D.SO2
3、煤是我国的一种主要能源,在使用煤资源时,下列所采取的措施不合理的是
A、燃煤时应将块煤粉碎或磨成粉末 B、燃煤时应通入足量的空气,且越多越好
C、将煤制成水煤气 D、将煤经过处理制成甲醇等
2、道尔顿的原子学说曾经起了很大作用.他的学说中,包含有下述三个论点:①原子是不能再分的粒子;②同种元素的原子的各种性质和质量都相同;③原子是微小的实心球体。从现代观点看,你认为这三个论点中不确切的
A、只有③ B、只有①③ C、只有②③ D、有①②③
1、铋(Bi)在医药方面有重要应用。下列关于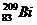 和
和 的说法正确的是
的说法正确的是
A.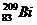 和
和 都含有83个中子
都含有83个中子
B.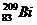 和
和 互为同位素
互为同位素
C.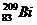 和
和 的核外电子数不同
的核外电子数不同
D.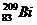 和
和 分别含有126和127个质子
分别含有126和127个质子
28、(14分)根据下列图示填空:已知:H是环状化合物C4H6O2, F中的碳原子在一条直线上

(1)写出化合物A中含有的官能团的结构简式:
(2)B在酸性条件下与Br2反应得到E,E在足量的氢氧化钠醇溶液作用下转变成F,由E转变成F时溶液中发生两种反应,其反应类型分别是: 、
(3)F的结构简式是
(4)1molA与2molH2在Ni作催化剂时并加热条件下发生反应生成1molG,其反应方程式为: 。
化学部分答案
选择题:
|
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
A |
B |
A |
D |
A |
A |
B |
填空题:
25、(1)14HNO3+3Cu2O=6Cu(NO3)2+2NO+7H2O;
(2)酸性、氧化性;
(3)0.6mol;
(4)使用硝酸的浓度增加,还原产物中将会有NO2,在还原剂相同(物质及用量)的情况下,还原产物降低价态越少,消耗的氧化剂越多。
26(1)氯碱工业 2NaCl+2H2O H2↑+C12↑+2NaOH
H2↑+C12↑+2NaOH
(2)2Fe2++Cl2=2Fe3++2Cl- FeO+2H+=Fe2++H2O
(3)FeC2O4
(4)NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);DH=-akJ/mol
27(1)用弹簧夹夹住导气管的乳胶管,打开分液漏斗的活塞,从分液漏斗向发生装置中注入蒸馏水,直到分液漏斗中留有一段水柱,静置片刻,观察分液漏斗中液面变化。如果液面不变,说明装置气密性良好,否则,气密性不好。
(2)分液漏斗; AgNO3 。
 (3)CH2OH(CHOH)4CHO+2Ag(NH3)2OH
(3)CH2OH(CHOH)4CHO+2Ag(NH3)2OH
CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O
(4) 防止倒吸
(5)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2+8H2O(合理答案即可)
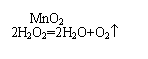
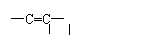 28(1) -CHO、-COOH、
28(1) -CHO、-COOH、
(2) 消去反应,中和反应 ;
|
(4)OHC-CH=CHCOOH+2H2-→HO-CH2-CH2-CH2-COOH ;
(5)CH2 = C(CHO)-COOH
27、 (14分)实验室需要少量的某些气体时,通常使用快速方法来制备,下列两个实验可快速制取实验中所需的少量气体,并进行相关实验。用下图甲所示装置进行实验,将A中液体逐滴加入B中,若B中盛装的是新制生石灰,实验中观察到C溶液中先形成沉淀,然后沉淀逐渐溶解,当溶液恰好澄清时,关闭A的活塞E,然后往烧杯中加入沸水,静止片刻,观察到试管壁上出现光亮的银镜。回答下列问题:
(14分)实验室需要少量的某些气体时,通常使用快速方法来制备,下列两个实验可快速制取实验中所需的少量气体,并进行相关实验。用下图甲所示装置进行实验,将A中液体逐滴加入B中,若B中盛装的是新制生石灰,实验中观察到C溶液中先形成沉淀,然后沉淀逐渐溶解,当溶液恰好澄清时,关闭A的活塞E,然后往烧杯中加入沸水,静止片刻,观察到试管壁上出现光亮的银镜。回答下列问题:
(1)如何检验气体发生装置的气密性
(2) A是 , C是(写化学式) 与葡萄糖的混和液。
(3)试管中生成银镜的化学方程式为: 。
(4)仪器D在此实验中的作用是: 。
(5)利用该气体发生装置还可以在实验室中快速制得哪些中学化学中常见的气体(用化学方程式列举2例) 。
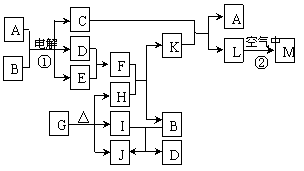
26、(18分)图表示各物质之间的转化关系。已知:常温下D、E、F、I、J为气体,且D、I是水煤气的主要成分;B是无色液体,M为红褐色固体,C的焰色反应为黄色。
(1)基于反应①原理的化学工业称为 ,写出该反应的化学方程式
(2)写出K和E反应的离子方程式_________。写出F溶液和H反应的离子方程式_____
__。
(3)已知:由G分解得到的H、I、J三者的物质的量之比为1∶1∶1,则G的化学式为 _ __。
(4)已知在稀溶液中1molC与1molF恰好完全反应放出akJ热量,写出该反应的热化学方程式 。
25、(12分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-®NO+2H2O。
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式 ;
(2)反应中硝酸体现了 性质;
(3)反应中若产生了0.2mol气体,则转移的电子的物质的量为 ;
 (4)若1mol甲与浓硝酸反应时消耗的硝酸物质的量将增加,其原因为:
。
(4)若1mol甲与浓硝酸反应时消耗的硝酸物质的量将增加,其原因为:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com