
题目列表(包括答案和解析)
4.下列叙述中,能证明某物质是弱电解质的是
A.熔化时不导电 B.水溶液的导电能力很差
C.属于共价化合物 D.溶液中已电离的离子和未电离的分子共存
3.下列物质加热熔化时破坏极性共价键的是
A.干冰 B.二氧化硅 C.晶体硅 D.氢氧化钠
2. 下列化学用语书写正确的是
下列化学用语书写正确的是
 A.甲醛的结构式HCHO B.四氯化碳的电子式
A.甲醛的结构式HCHO B.四氯化碳的电子式
C.环丙烷的最简式CH2 D. 的名称:2-乙基丙烷
1.下列物质的用途中,利用物质氧化性的是
A.氧化铝做耐火材料 B.K、Na合金作原子反应堆导热剂
C.焦炭用于炼铁工业 D.次氯酸消毒餐具
30、(4分)在25℃时,将7.2g镁条放入过量的100mL稀盐酸中。反应开始至1min末收集到氢气2.24L(标准状况下),1min末到2min末时镁条减少3.6g,在此之后,又经过2min镁条全部溶解,假设反应前后溶液体积始终为100mL,则:
⑴在反应开始至1min末时间用MgCl2表示的平均反应速率为多少?
⑵在1min末到2min时间用HCl表示的平均反应速率为多少?
杭州学军中学2009学年下学期期中考试高一化学
29、(10分).电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
X电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
28、(10分).观察图A、B、C,回答下列问题:
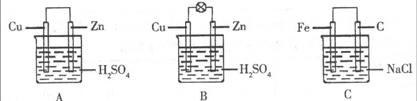
(1)把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察到锌片上有气泡,再平行插入一块铜片,可观察到铜片______(填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见图A),组成一个原电池,正极的电极反应式为 。
(2)如果烧杯中最初装入的是2mol/L 500mL的稀硫酸溶液,构成铜锌原电池(见图B,假设产生的气体没有损失,锌失去的电子完全沿导线到铜电极),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计) 、 。
(3)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(见图C),放置数天后,写出正极的电极反应式 。
(4)生活中利用原电池原理生产了各种各样的电池,废电池必须进行集中处理的问题已被提到议事日程,其最主要原因是 。
A.回收利用电池外壳的金属
B.防止电池中汞、镉和铅等重金属离子对土壤、水源的污染
 C.防止电池中渗泄的电解液腐蚀其他物品
C.防止电池中渗泄的电解液腐蚀其他物品
D.回收其中的石墨电极
27、(17分).(1)主族元素A和B的形成的离子分别是A2+和B2-,两种离子都有n层电子,且最外层电子数均是8个,若用n表示周期数时,则元素A处于 周期 族;元素B处于 周期 族。
(2).已知 N、P同属于元素同期表的 VA族元素,N在第二周期,P在第三周期。NH3分子呈三角锥形,N原子位于锥顶,三个H原子位于锥底,N-H键间的夹角是107018/
①PH3分子的构型为________________,P-H_______________极性(填“有”或“无”),PH3分子_____(填“易”或“难”)溶于水。
②NH3与PH3相比,热稳定性___________________更强。
③NH3、PH3在常温、常压下都是气体,但NH3比PH3易液化,其主要原因是______。
(3).已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B.C同主族,A 与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子的分子。写出下列物质的电子式:
E与B形成的化合物_________________________________________。
A、B、E形成的化合物______________________________________________。
D与E形成的化合物________________________________________________。
C、D、E形成的离子化合物__________________________________________。
2、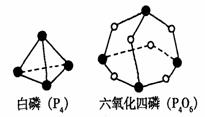 化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构,如下图所示;现提供以下化学键的键能:P-P 198KJ·mol-1,P-O 360kJ·mol-1
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构,如下图所示;现提供以下化学键的键能:P-P 198KJ·mol-1,P-O 360kJ·mol-1
氧气分子内氧原子间的键能为498kJ·mol-1则
P4+3O2=P4O6的△H为: ;
Ⅱ、(5分)下表是稀硫酸与某金属反应的实验数据:
|
实验
序号 |
金属
质量/g |
金属
状态 |
C(H2SO4) /mol·L-1 |
V(H2SO4)
/mL |
溶液温度/℃ |
金属消失
的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
|
2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
|
3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
|
4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
|
5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
|
6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
|
7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
|
8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
|
9 |
0.10 |
丝 |
1.1 |
50 |
20 |
44 |
40 |
分析上述数据,回答下列问题:
①实验4和5表明, 对反应速率有影响,
能表明同一规律的实验还有 (填实验序号);
②仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
③本实验中除上表中所列的因素外,影响反应速率的其他因素还有 ,其实验序号是 。
Ⅲ、(4分)在一定条件下发生反应2SO2(g)+O2(g)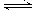 2SO3(g);
2SO3(g);
500℃时,将a mol SO2与b mol O2以3:2通入固定容积为5L的密闭容器中。
①反应进行至10min时,测得n(SO2)=8mol,n(SO3)=4mol则b=___________mol。
②10min内平均速率v(SO2)= mol/(L·min)。
241.8kJ,写出该反应的热化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com