
题目列表(包括答案和解析)
8.据最新报道,科学家发现了如下反应: ,已知
,已知 为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是
为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是
A. 中氧元素的化合价是+1价
中氧元素的化合价是+1价
B.在此反应中,O2是氧化剂,PtF6是还原剂
C. 中不存在共价键
中不存在共价键
D.在此反应中,每生成1mol
 则转移1mol电子
则转移1mol电子
7.下列物质的工业制备的反应原理错误的是
A.制金属钠:
B.制漂粉精: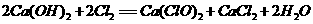
C.制乙烯:
D.制盐酸:
6.化学与生活、社会密切相关。下列说法不正确的是
A.含氯消毒剂等物质能对甲型H1N1流感病毒有一定杀灭作用
B.庆祝国庆六十周年晚会燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
C.为了减少“白色污染”,我国规定商家不得无偿提供塑料袋
D.当前,我国西南许多地方出现了旱情,缓解旱情的措施之一是用溴化银进行人工增雨
31.粉煤灰是燃煤电厂排出的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为43.4%,还有含量较多的SiO2(其他成分不含Al和Si)。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式为:
Al6Si2O13 + 3Na2CO3 → 2NaAlSiO4+ 4NaAlO2 + 3CO2↑ ①
Al6Si2O13 + 5Na2CO3 → 2Na2SiO3 + 6NaAlO2 + 5CO2↑ ②
SiO2 + Na2CO3 → Na2SiO3 + CO2↑ ③
(1)粉煤灰中铝的质量分数为 % 。
(2)用1 mol Al6Si2O13 和 4 mol SiO2制得5mol NaAlO2、1mol NaAlSiO4,还应制得Na2SiO3____________mol,共消耗Na2CO3 mol(得到的固体中无SiO2)。
(3)若粉煤灰中 Al6Si2O13 与 SiO2的物质的量之比为1:2,则1kg粉煤灰与6mol Na2CO3反应(反应物全部都参与反应),可制得NaAlO2_________________mol。
(4)若用100 mol Al6Si2O13同时生产NaAlSiO4和NaAlO2,且n(NaAlSiO4):n(NaAlO2) = x,消耗Na2CO3 y mol,试确定y与x的关系式。
2009学年第二学期徐汇区高三年级化学学科
|
流水号 |
||
|
|
|
|
30.用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路是成熟的传统工艺,现对某印刷电路生产厂家蚀刻绝缘板后所得的混合溶液(标记为A)进行如下分析:
①取50.0mL A溶液加入足量的硝酸银溶液,析出沉淀86.1g
②取50.0mL A溶液试探性地加入1.12g铁粉,结果全部溶解未见固体析出
③向实验②所得溶液中加入50 mL稀硝酸,产生1.12L NO(标准状况),反应后所得溶液的pH为1。
结合上述信息计算:
(1)所得沉淀的物质的量_____________mol;
(2)该厂所使用的FeCl3溶液的物质的量浓度_____________mol/L;
(3)A溶液中Cu2+的物质的量浓度。
29.已知:①NaNO2具有强氧化性
②
奥沙拉秦是一种抗菌药。其合成路线如下:
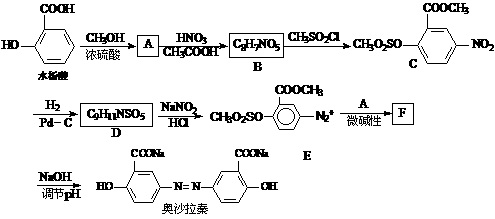
(1)写出下列反应的化学方程式:
水杨酸→A_________________________________________________________;
A→B __________________________________________________;
(2)写出D的结构简式______________________;
(3)写出下列反应的反应类型:D→E______________,F→奥沙拉秦___________;
(4)从整个合成路线看,设计B→C步骤的作用是___________________________;
(5)F的结构简式为___________________;
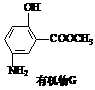 (6)有机物G(结构简式见下图)也可用于合成奥沙拉秦。它的一种同分异构体X是
(6)有机物G(结构简式见下图)也可用于合成奥沙拉秦。它的一种同分异构体X是 -氨基酸,能与FeCl3发生显色反应,其分子中共有6种化学环境不同的H原子。X的结构简式为________________
-氨基酸,能与FeCl3发生显色反应,其分子中共有6种化学环境不同的H原子。X的结构简式为________________
28. 烯烃中碳碳双键是重要的官能团,在不同条件下能发生多种变化。异松油烯是应用广泛的工业原料,它与水反应(摩尔比1:1)可得到γ-松油醇(结构见右图)。
烯烃中碳碳双键是重要的官能团,在不同条件下能发生多种变化。异松油烯是应用广泛的工业原料,它与水反应(摩尔比1:1)可得到γ-松油醇(结构见右图)。
(1)写出γ-松油醇的分子式_______,该物质所属的物质类别为_______(填编号);
a.烯烃 b.环烃 c.醇
(2)下列反应中,γ-松油醇不能发生是___________(填编号);
a.与HCl发生取代反应 b.与HCl发生加成反应
c.在灼热铜丝催化下发生氧化反应 d.聚合反应
(3)已知异松油烯分子中有3个甲基,则其结构简式为__________________;
(4)异松油烯的同分异构体中,能与溴水发生1,4 –加成的共有_____种(仅考虑官能团位置异构),写出其中一种的结构简式________;
27.卤水中的主要成分为食盐(假设其所含杂质仅为NaBr),为了充分利用资源,有研究人员开发了以晒盐卤水和化肥碳酸氢铵为原料制取纯碱的工艺,其生产流程如下图。


(1)写出卤水和碳酸氢铵反应的化学方程式_______________;
(2)操作I是_________(填操作名称),试剂X为________,残液除NH4Cl外,还含有_________;
(3)若滤渣中含有NH4Cl杂质,则可能导致纯碱中混有杂质,写出煅烧时产生杂质的副反应的化学方程式__________________;
(4)实验室检测滤渣中是否含有NH4Cl的操作是_________________;
 (5)碳酸氢铵与氯化钠的配料比是影响纯碱质量的因素之一,右图是(摩尔比)对NaHCO3产率的影响。实际生产中选择=1.2。
(5)碳酸氢铵与氯化钠的配料比是影响纯碱质量的因素之一,右图是(摩尔比)对NaHCO3产率的影响。实际生产中选择=1.2。
①下列相关说法正确的是___________。
a.碳酸氢铵过量是为了充分利用卤水
b.碳酸氢铵过量是为了减少纯碱中的NaCl
c.碳酸氢铵过量太多将会导致生产成本过高
②不考虑生产过程中的损耗,生产1mol纯碱,需消耗碳酸氢铵________mol。
26.某兴趣小组对如何延长硫酸亚铁溶液的保质期展开了研究。
(1)制备硫酸亚铁溶液,最合适的试剂组为___________(填编号);
a.过量铁屑和稀硫酸 b.过量稀硫酸和铁屑 c.过量硫酸铁溶液和铁屑
(2)实验室保存硫酸亚铁溶液的一般方法是_____________________________________;
该兴趣小组取等体积的硫酸亚铁溶液分别加入三个烧杯中,各滴入3 滴KSCN试剂,然后进行如下实验:
|
烧杯编号 |
① |
② |
③ |
|
加入试剂 |
铁粉0.1g |
铁粉0.1g,0.1mol/LH2SO43mL |
0.1mol/LH2SO43mL |
|
红色出现时间(天) |
1天 |
4天左右 |
8天以上 |
(3)在烧杯②中加入2种试剂后,即可观察到的现象为_____________________________;
(4)通过比较上述3组实验,可以得出的结论为___________________________________;
(5)硫酸亚铁溶液在空气中易氧化,氧化产物易水解生成Fe(OH)3,导致溶液酸性增大。
①试用一个离子方程式表示上述反应过程中的变化_________________________;
②硫酸亚铁溶液在空气中变质的反应为可逆反应,试用化学平衡理论解释烧杯③出现红色最晚的原因____________________________________________________。
25.SO2与O2在催化剂作用下合成SO3的反应为:2SO2(g)+O2(g)  2SO3(g)。在容积均为1L的a、b、c、d、e五个密闭容器中均充入1mol O2和2mol SO2混合气体,控温。反应进行5min时,测得相关数据如下表:
2SO3(g)。在容积均为1L的a、b、c、d、e五个密闭容器中均充入1mol O2和2mol SO2混合气体,控温。反应进行5min时,测得相关数据如下表:
 容器温度 容器温度浓度 |
a容器 400℃ |
b容器 425℃ |
c容器 450℃ |
d容器 475℃ |
e容器 500℃ |
|
c(O2) |
0.8 |
0.6 |
0.3 |
0.5 |
0.7 |
|
c(SO3) |
0.4 |
0.8 |
1.4 |
1.0 |
0.6 |
(1)反应进行5min内,五个容器中平均反应速率最大的是_______________(填容器编号);
(2)计算a容器中O2的反应速率_________________;

 (3)写出该反应的平衡常数表达式K=___________________,比较上表中数据,推测可能达到平衡的容器是_____________(填容器编号);
(3)写出该反应的平衡常数表达式K=___________________,比较上表中数据,推测可能达到平衡的容器是_____________(填容器编号);
(4)该反应是________(填“放热”、“吸热”)反应,在右图坐标中画出e容器中SO3的物质的量随时间的变化曲线。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com