
题目列表(包括答案和解析)
2.过滤,洗涤,干燥,称量固体。该步骤中若未洗涤固体,测得镁的质量分数将_____________(填“偏高”、“偏低”或“无影响”)
请写出洗涤沉淀的具体操作方法:_____________________________________
方案二:将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20 oC,101KPa)的体积。
8.(18分)
镁铝合多已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
方案一:将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是______________________________________
实验步骤:1.称取5.4g铝镁合金样品,溶于VmL2.0mol/LNaOH溶液中,为使其反应完全,则NaOH溶液的体积V≥___________
7.(14分)有A、B、C三种短周期元素在周期表中相对位置如下:
|
A |
|
|
|
|
|
|
B |
C |
(1)A与B、A与C形成的液体化合物是常见的重要溶剂,则A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:_________>_________>___________(用化学式表示)。
(2)B、C两种元素对应单质分别为X、Y。标准状况下,X的密度为3.17g/L。Z是一种化合物,焰色反应呈紫(透过钴玻璃), 0.1mol/L Z水溶液pH=13 。X、Y、Z有如图转化关系:
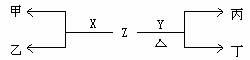
① 写出X与Z反应的离子方程式:______________________________________
② 已知丙能与稀硫酸反应生成使品红褪色的气体。
丁的化学式________________,
丁的水溶液pH>7原因______________________________________(用离子方程表示)
将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/L KMnO4(aq)(硫酸酸化)中,恰好褪色。写出反应的离子方程式__________________________________________
③ 石墨和铁做电极,用隔膜电解槽(不考虑产物之间相互反应)电解甲的溶液,阳极产生气体X,铁做________极,写出电解甲溶液的离子方程式__________________________
④ 实验室用含X元素的一种化合物E制取O2 ,工业上用无隔膜电解槽(考虑产物之间相互反应)电解甲的溶液生产化合物E,假设电解时电解槽进液口溶液中甲浓度为2mol/L,出液口溶液中甲浓度为1.6mol/L(进出口流量相同)则出液口溶液E浓度是____________mol/L 。
6.下列说法不正确的是:
A.0.1mol/LH2S溶液中,c(H+)>c(HS-)+c(S2-)+ c(OH-)
B.0.1mol/LCH3COONa溶液的pH=8,则 c(OH-)-c( CH3COOH)=1×10-8mol/L
C.pH与体积都相同的硫酸和醋酸溶液,分别与同物质的量浓度、同体积的Na2CO3溶液反应,若在相同条件下放出CO2的量相同,则Na2CO3恰好与醋酸完全反应或两种酸均过量。
D.将20mL0.4mol/L硝酸铵溶液和50mL0.1mol/L氢氧化钡溶液混合,混合溶液中各离子浓度的大小顺序是:c(NO3-)>c( Ba2+) >c(OH-)>c( NH4+)
II卷(60分) (请将答案写在答题纸上)
5.已知溶液中存在平衡: Ca(OH)2(s)  Ca2+ (aq) + 2OH-(aq) 下列有关该平衡体系的说法正确的是:
Ca2+ (aq) + 2OH-(aq) 下列有关该平衡体系的说法正确的是:
A.升高温度,平衡逆向移动
B.溶液中c(Ca2+ ) ·c2(OH--)恒为定值
C.向溶液中加入少量碳酸钠粉末能增大钙离子浓度
D.除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的氢氧化钠溶液
4.下述实验中不能达到预期实验目的的是:
|
编号 |
实验内容 |
实验目的 |
|
A |
C2H5Cl和NaOH溶液混合后振荡再加入AgNO3溶液 |
检验C2H5Cl中的Cl元素 |
|
B |
向沸腾的水中滴加FeCl3饱和溶液,继续煮沸至溶液呈红褐色为止 |
制备Fe(OH)3胶体 |
|
C |
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 |
研究浓度对反应速率的影响 |
|
D |
室温下,用pH计测定浓度为0.1mol/LNaClO溶液CH3COONa溶液的pH |
比较HClO和CH3COOH的酸性强弱 |
3.在给定条件下,下列画线的物质在化学反应中能被完全消耗的是:
A.用50mL8mol/L浓盐酸与10g二氧化锰共热热制取氯气
B.标准状况下,将1g铝片投入20mL18mol/L的硫酸中
C.向100mL3mol/L的硝酸中加入 5.6g铁
D.在5×107Pa、500℃和铁触媒催化的条件下,用氮气和氢气合成氨
2.下列说法正确的是:
A.氢化锂三兄弟-LiH、LiD、LiT三种物质的质子数之比为4:5:6
B.一个乙醛分子中存在6对共用电子
C.将地下输油管与外加直流电源的正极相连,可以保护它不受腐蚀。
D.原子序数相差8的两种短周期元素,其周期序数必相差1。
1.下列说法正确的是:
A.偏爱食用味觉上具有酸味的食物即酸性食物,会导致血液偏酸性,引起缺钙。
B.在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮,氧化变质。
C.按分散剂可将分散系分为溶液,胶体和浊液;漂白粉、福尔马林、钢、王水、氯水均为混合物
D.食品添加剂种类很多,其中一种为苯甲酸钠,它是苯的一种同系物所对应的钠盐。
8.
根据生产流程,回答下列问题:
(1) 写出B的结构简式 , C8H602Br2的结构简式
(2)写出反应①的化学方程式
(3)反应②④⑥⑧⑩中属于取代反应的是 ,设计反应③④⑤的目的是
(4) E与乙二醇发生聚合反应的化学方程式
29(18分〉
硫酸铜是一种应用极其广泛的化工原料.某课外兴趣小组将适量浓硝酸分多次加到铜粉与稀
硫酸的混合物中,加热使之反应完全(装置如题29图I、图Ⅱ所示),通过蒸发、结晶得到硫酸铜晶体,并同时测定硫酸铜晶
体中结晶水的含量
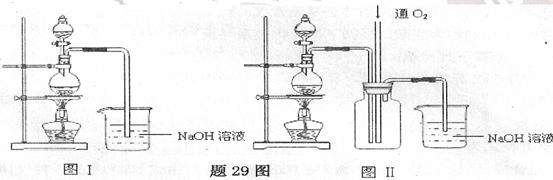
(1)怎样检查图I装置的气密性
(2)图I中分液漏斗内装的液体是
(3)图Ⅱ是图I的改进装置,与图I相比,图Ⅱ装置的明显优点是
(可不答满).
(4)课外兴趣小组同学在测定胆矶(CuS04 • XH2O)晶体中结晶水的含量时.测得有关数据如下表:
|
加热前质量 |
加热后质量 |
- |
|
|
m1(容器〉 |
m2〈容器+晶体〉 |
m3(容器+无水CuS04) |
|
|
5.4g |
7.9g |
6.8g |
|
①为完成测定,题29图Ⅲ中还缺少的仪器名称是
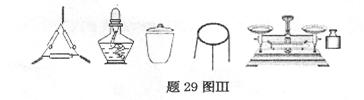
②判断样品己恒重的方法是
③测定所得胆矶(CuS01'xffiO)中结晶水含量的实验中,称量操作至少进行 次.
④课外兴趣小组的测定结果x值(与CuS04 • 5H20相比) (填"偏高"、"偏低"、"不变”),可能的
原因是 .(填字母序号〉
a.加热温度过高 b.胆矾晶体的颗粒较大 c.加热后放在空气中冷却 d.胆矾晶体部分风化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com