
题目列表(包括答案和解析)
30.(16分)以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:

氯化铵和硫酸钠的溶解度随温度变化如下图所示:


回答下列问题:
(1)由原料得到产品的反应方程式为: 。
(2)必须“趁热过滤”的原因是 。
(3)滤液1中除水外,还含有的主要成分是 。
(4)该流程中,可循环利用的物质是 。
23.
 粗镍经过下列过程可以转化为纯度99.9%的高纯镍,发生的反应是
粗镍经过下列过程可以转化为纯度99.9%的高纯镍,发生的反应是
下列说法正确的是
A.50-80℃时,适当增大压强,有利于Ni(CO)4的生成
B.180-200℃时,气态的Ni(CO)4 会分解出纯Ni
C.提纯过程中,CO(g)的量不断减少
D.温度越高,Ni(CO)4 (g)的转化率越低
22.下列各溶液中的表述正确的是
A.0.1 mol·L-1NH4Cl溶液:c(NH4+)=c(Cl-)
B.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
C.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-)
D.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子有CO32-、HCO3-、OH-
12.元素X、Y、Z原子序数之和为36,X、
Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测正确的是
A.同周期元素中X的最高价氧化物对应的水化物碱性最强
D.Y的最高价含氧酸的化学式可表示为H2YO4
C.同族元素中Z的氢化物稳定性最低
B.原子半径X>Y,离子半径X+>Z2-
11.迷迭香酸是从蜂花属植物中提取得到的
酸性物质,其结构如右图。下列叙述错误的是
 A.迷迭香酸可以发生取代反应
A.迷迭香酸可以发生取代反应
B.迷迭香酸可以发生酯化反应
C.迷迭香酸可以发生水解反应
D.1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应
10.设nA 代表阿伏加德罗常数的数值,下列说法正确的是
A.1 mol硫酸钾中阴离子所带电荷数为nA
B.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为nA
C.0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nA Fe3+
9.下列有关说法正确的是
A.太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
B.天然气、沼气和水煤气均属于可再生能源
C.硫酸、纯碱、醋酸钠分别属于酸、碱、盐
D.生铁、普通钢和不锈钢中的碳含量依次增加
8.下列有关说法正确的是
A.锌锰干电池中,锌电极是正极
B.电解MgCl2饱和溶液,可制得金属镁
C.锡青铜(铜锡合金)文物在潮湿环境中的腐蚀比干燥环境中快
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
7.下列有关实验操作的说法正确的是
A.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
B.可用25mL碱式滴定管量取20.00 mLKMnO4 溶液
C.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
D.向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液除去乙酸乙酯中的少量乙酸
(二)选考题:(共15分,请考生从给出的3道试题中任选一题做答。如果多做,则按所做的第一题计分。)
29.[化学一一选修化学与技术](15分)
硫酸工厂排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前必需进行尾气处理并设法进行综合利用。
(1)硫酸工厂排放尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理。
①写出上述过程的化学反应方程式:
,
②请说出这种尾气处理方法的优点(说出两点即可)
③若某硫酸厂每天排放的1万米3。(标准状况)尾气中含0.2%(体积百分数)的SO2,通过上述方法处理,理论上需生石灰 kg。
(2)近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,该方法:第一步是用Na2SO3水溶液吸收SO2,第二步是加热吸收溶液,可得到含高浓度SO2的水蒸气副产品。
这种尾气处理方法与(1)相比的优点是 。
 (3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO。溶液进行电解循环再生,这种新工艺叫再生循环脱硫法;其中阴阳膜组合循环再生机理如A图,a、b离子交换膜将电解槽分为三个。区域,电极材料为石墨。
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO。溶液进行电解循环再生,这种新工艺叫再生循环脱硫法;其中阴阳膜组合循环再生机理如A图,a、b离子交换膜将电解槽分为三个。区域,电极材料为石墨。
①图中a表示 离子交换膜(填“阴”或“阳”)。A-E分别代表生产中的原料或产品,其中C为硫酸,则A表示 ,E表示 。
②阳极的电极反应式为 。
 30.[化学一一选修物质结构与性质](15分)
30.[化学一一选修物质结构与性质](15分)
有A、B、C、D、E、F六种元素,A是周期表中原
子半径最小的元素,B是电负性最大的元素,C的2p轨
道中有三个未成对的单电子,F原子核外电子数是B与
C核外电子数之和,D是主族元素且与E同周期,E能
形成红色(或砖红色)的E2O和黑色的EO两种氧化物,
D与B可形成离子化合物其晶胞结构如右图所示。请
回答下列问题。
(1)E元素原子基态时的电子排布式为 ;
(2)A2F分子中F原子的杂化类型是 ,F的氧化物FO3分子空间构型为
;
(3)CA3极易溶于水,其原因主要是 ,试判断CA3溶于水后,形成CA3·H2O的合理结构 (填字母代号),推理依据是:
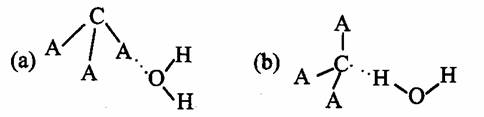 。
。
(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合物晶体的密度为ag·cm-3。,则晶胞的体积是 (写出表达式即可)。
31.[化学一一选修有机化学基础](15分)
高效低毒杀虫剂氯菊酯(I)可通过下列合成路线制备:

(1)化合物A能使溴的四氯化碳溶液褪色
①A的化学名称是 ,B的结构简式 ;
②化合物I中官能团的名称是 ;
③在化合物E转化成化合物F的反应中,能否用NaOH/C2H5OH代替C2H5Ona/C2 H5OH溶液? (填“能”或“不能”),其原因是
。
④化合物H的结构简式为 ,写出由G生成I的化学反应方程式
,写出由G生成I的化学反应方程式
(2)芳香化合物J比F少两个氢,J的分子核磁共振氢谱有三个峰,峰面积之比是9:2:1,则J可能的结构简式为(写出1种即可)
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com