
题目列表(包括答案和解析)
17.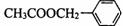 (8分)茉莉花香气的成分有多种,乙酸苯甲酯(
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
(8分)茉莉花香气的成分有多种,乙酸苯甲酯(
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
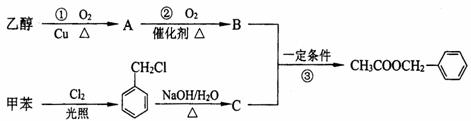

(1)写出反应①的化学方程式:
(2)反应③的反应类型为
(3)C的结构简式为
(4)上述①②③三个反应中,原子的理论利用率为100%,符合绿色化学的要求的反应是 (填序号)。
选考题(第18-1、18-2题为《有机化学基础》模块题,第19-1、19-2题为《物质结构与性质》模块题,第20-1、20-2题为《化学与技术》模块题,每个模块满分均为20分。考生只能从三个模块中任选一个作答,不得跨模块答题,否则只能以所答的第一个模块计分。答题前,请用2 B铅笔在答题卡上把所选模块对应的标号涂黑。注意所做模块题必须与所涂模块相同。)
《有机化学基础》
18-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)
下列关于有机物的说法中,正确的是 ( )
A.蔗糖是高分子化合物,其水解产物能发生银镜反应
B.橡胶和纤维不一定都是合成高分子材料
C.常温下淀粉遇碘酒变蓝色,葡萄糖能与新制Cu(OH)2发生反应
D.将某烃类的混合气体跟Cl2混合光照,发现有油状液滴生成,说明混合气体肯定含有甲烷
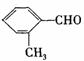
E. 分子中所有原子不可能共平面
18-2.(14分) 已知:一个碳原子上连有两个羟基时,易发生下列转化:
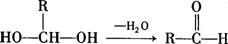
 请根据下图作答:
请根据下图作答:

(1) A的核磁共振氢谱中出现 组峰;E中含有的官能团的名称是
(2)反应③的化学方程式为
(3)已知B的相对分子质量为162,其完全燃烧的产物中CO 2和H2O的物质的量之比为 n(CO2) ︰n (H2O)=2︰1,则B的分子式为
(4)F是高分子光阻剂生产中的主要原料。F具有如下特点:①属于芳香族化合物;②能跟FeCl3溶液发生显色反应;③能发生加聚反应;④苯环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为
(5)化合物G是F的同分异构体,属于芳香族化合物,能发生银镜反应。G有多种可能的结构,请写出它们的结构简式
《物质结构与性质》
19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列说法正确的是 ( )
A.基态原子中不一定都有未成对的电子
B.由极性键形成的分子一定是极性分子
C.晶格能大小顺序:NaCl > KCl
D.离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子
E.在CaO和SiO2晶体中,都不存在单个小分子
19-2.(14分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
 基态原子核外有两个电子层,最外层有3个未成对的电子 基态原子核外有两个电子层,最外层有3个未成对的电子 |
基态原子的M层有1对成对的p电子 |
基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的基态电子排布式 。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 。
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,
 “ O”表示氢原子,小黑点“ ·”表示没有形成共价键的最外层电子,短线表示共价键。
“ O”表示氢原子,小黑点“ ·”表示没有形成共价键的最外层电子,短线表示共价键。
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键和 个π键。
《化学与技术》
20-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列有关工业生产的叙述正确的是 ( )
A.合成氨生产过程中将NH3液化分离,可以提高N2、H2转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
E.炼铁过程中碳被氧化,既起产生热量的作用,又起产生CO的作用
20-2.(14分)海南省是海洋大省,海水是人类宝贵的自然资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:
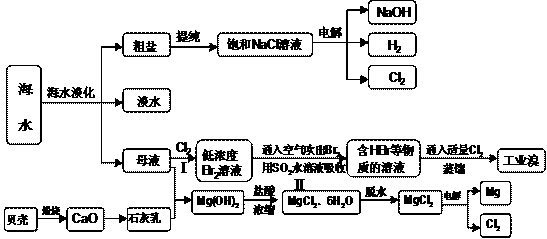

(1)请列举海水淡化的两种方法 、 。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br -,其目的是: 。
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
(3)在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2.6H2O的原因
(4)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以
用做镁蒸气的冷却剂的是 ( )
A.H2 B.CO2
C.空气 D.O2 E.水蒸气
(5)从各种经营综合开发,打造大而强的现代企业以及本厂生产所需要的原料等方面来
看,你认为该化工厂还可以再增加的生产项目的 。
16. (9分)用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(9分)用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所推出的结论是:第一:有氧气生成;第二: 。
Na2O2跟水反应的化学方程式是 。
(2)某研究性学习小组拟用右图所示装置(气密性良好)进行实验,以证明上述结论。
①用以验证第一条结论的实验操作及现象是:
②用以验证第二条结论的实验操作及现象是:
(3)实验(2)向试管中加水至固体完全溶解且不再有气泡生成后,滴入酚酞试液,发现溶液先变红后褪色,为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氧化性和漂白性。请从另外一个角度(即不能再使用酸碱指示剂)设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。
。
15.(9分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
(1)氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用。
①下图是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: 。(△H的数值用含字母a、b的代数式表示)
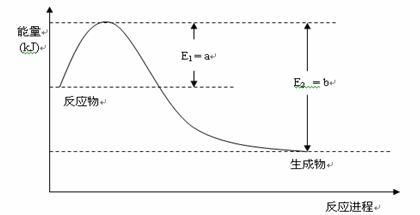
②氨气溶于水得到氨水。在25°C下,将m mol·L-1的氨水与n mol·L-1的盐酸等体积混合,反应后的溶液呈中性,则c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含m和n的代数式表示出混合液中氨水的电离平衡常数表达式 。
 (2)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。
(2)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。
25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入适量0.1mol·L-1的NaI溶液,振荡、静置,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时 )
)
14.(10分)能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
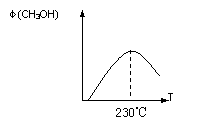 (1)合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);△H
(1)合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);△H
右图表示某次合成实验过程中甲醇的体积分数
φ(CH3OH)与反应温度的关系曲线,
 则该反应的△H
0(填“>、< 或 = ”)
则该反应的△H
0(填“>、< 或 = ”)
(2)若在230℃时,平衡常数K=1。若其它条件不
变,将温度升高到500℃时,达到平衡时,K 1
(填“>、< 或 = ”)
 (3)在某温度下,向一个容积不变的密闭容器中通
(3)在某温度下,向一个容积不变的密闭容器中通
入2.5mol CO和7.5mol H2,达到平衡时CO的转化
率为90%,此时容器内的压强为开始时的 倍。
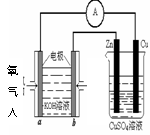
(4)利用甲醇燃料电池设计如右图所示的装置:
则该装置中Cu极为 极;
写出b极的电极反应式
当铜片的质量变化为12.8 g时:a极上消耗的O2在
标准状况下的体积为 L。
13.(8分)下图为一些常见物质间的相互转化关系,其中F为金属,高温下能与某些金属氧化物反应,是工业冶炼金属的方法之一。 A为无色气体,B为淡黄色固体,C为无色液体,E和J为无色气体单质。
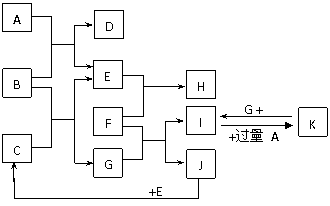
试回答下列问题:
(1) 写出B的化学式: ,写出A的电子式 ;
(2)写出I→K的离子方程式 ;
(3)写出F与Fe3O4在高温下反应的化学方程式 ;
(4)已知3g J完全燃烧放出a kJ的热量,请写出表示J的燃烧热的热化学方程式:
。
12.已知2Fe2+ +Br2=2Fe3++2Br-。向10mL0.1mol·L-1 的FeBr2溶液中通入0.001mol Cl2,反应后的溶液中,除含有Cl-外还一定 ( )
A.含Fe2+,不含Fe3+ B.含Fe3+,不含Br-
C.含Fe3+,含有Br- D.含Fe2+,含有Fe3+
第Ⅱ卷(共64分)
11.关于浓度均为0.1 mol/L的三种溶液:①CH3COOH、②NaOH、③CH3COONa溶液,下列说法不正确的是 ( )
A.c(CH3COO-):③>①
B.水电离出的c(OH-):②>①
 C.①和②等体积混合后的溶液: c(OH
C.①和②等体积混合后的溶液: c(OH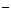 )=c(H+)+ c(CH3COOH)
)=c(H+)+ c(CH3COOH)
D.①和③等体积混合后的溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
10.以下物质间的转化通过一步反应不能实现的是 ( )
A.HCl →Cl2→HClO→NaClO
B.Na→Na2O2→Na2CO3→NaHCO3
C.Si→SiO2→H2SiO3→Na2SiO3
D.Al→NaAlO2 →Al(OH)3→Al2O3
9.右表是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21。下列说法正确的是 ( )
|
|
X |
|
Y |
|
Z |
|
W |
|
A.X元素可形成六种氧化物
B.Y元素的最高价氧化物的水化物是含氧酸中酸性最强的
C.X元素的非金属性比Y元素非金属性强
D.Z和X能以共价键结合形成一种无机非金属材料
8. 在下列各溶液中,离子可能大量共存的是 ( )
在下列各溶液中,离子可能大量共存的是 ( )
A.透明的溶液中:Cu2+、Fe3+、NO3-、、Cl-
B.使pH试纸变红的溶液中:NH4+、Na+、SO42-、Cl-
C.含有大量ClO-的溶液中:K+、H+、I-、SO32-
D.水电离产生的c(H+) =10-12mol·L-1的溶液中:Na+、Fe2+、SO42-、NO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com