
题目列表(包括答案和解析)
21.(12分)有机物A1和A2分别和浓H2SO4在一定温度下共热都只生成烃B,B的蒸气密度是同温同压下H2密度的59倍,在催化剂存在下,1mol B可以和4mol H2发生加成反应,B的一元硝化产物有三种(同种类型)。有关物质之间的转化关系如下:
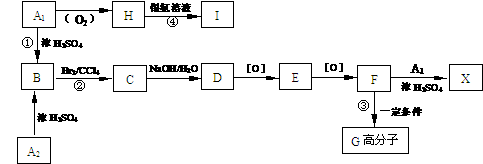
(1)反应①属于 反应,反应②属于 反应
(2)写出A2和X两种物质的结构简式:
A2
(3)书写化学方程式:
③
④
(4)化合物E有多种同分异构体,其中属于酯类且具有两个对位侧链的同分异构体有四种,分别写出它们的结构简式:
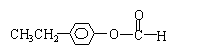
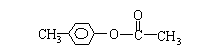
[答案]
(1)消去 加成
(2) (3)
(3)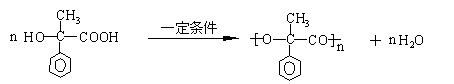
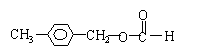
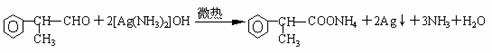 (4)
(4)
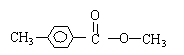
雅礼中学2010届高三元月质量检测
20.(10分)某校化学小组的同学开展测定Na2CO3和NaCl的固体混合物中Na2CO3质量分数的探究实验,他们提出下列实验方案。
[方案一]气体分析法
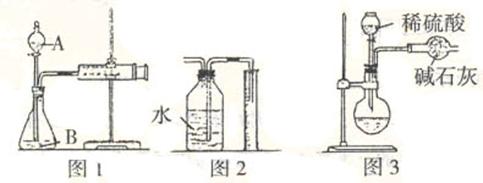
(1)甲同学用图1所示装置,把xg的混合物与足量稀硫酸反应后,测定产生的C02气体的体积。实验开始时检查该装置气密性的方法是 。
(2)乙同学用图2代替图1中的收集装置,则所测CO2气体的体积偏小,你的改进方案是 。
(3)丙同学用图3装置测 定CO2的质量,该装置存在较多缺陷,从而导致实验误差,请你补充其中的一点缺陷:
定CO2的质量,该装置存在较多缺陷,从而导致实验误差,请你补充其中的一点缺陷:
Ⅰ没有吸收圆底烧瓶水蒸汽的装置;
Ⅱ球形干燥管与空气相通
Ⅲ 。
[方案二]沉淀分析法(如图所示)。
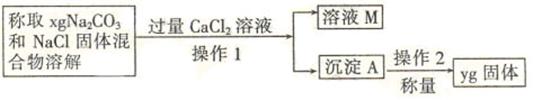
(4)在进行操作1之前,应判断是否沉淀完全,判断的方法是
。
(5)根据沉淀分析法,该固体混合物中Na2CO3质量分数的计算式为 。
[答案](1)关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,若活塞能回到原位,证明不漏气,否则漏气。
(2)将广口瓶中的水改为饱和CO2水溶液(或在水面上覆盖一层植物油等)。
(3)Ⅲ反应结束后,装置内残留的C02不能完全排出。(其他合理答案可酌情给分)
(4)静置,在上层清液中继续滴加CaCl2溶液,若无沉淀证明沉淀已完全。
(5) 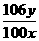
19.(10分)下面是元素周期表的一部分,表中所列字母分别代表某一化学元素。
|
a |
|
b |
|||||||||||||||
|
|
|
|
|
|
c |
d |
|
|
|||||||||
|
e |
|
f |
|
|
|
g |
h |
||||||||||
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
j |
(1)i是铁元素,其原子的最外层电子数为2,请写出铁元素的原子结构示意图____。
(2)NH3·H2O的电离方程式NH3·H2O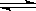 NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构_________(填字母代号)。
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构_________(填字母代号)。
(a)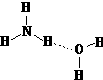 (b)
(b)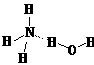
(3)上表中的c原子间也可形成链状结构,假设c原子间只以单键形式连接,并形成与直链烷烃类似的氢化物,则该系列氢化物的通式为___________________。
(4)利用稀有气体化合物,人们实现了许多制备实验上的突破。如用j的+6价氧化物在碱性条件下与NaBrO3反应生成NaBrO4, 同时生成j的单质。写出上述反应的方程式_____
_______。
同时生成j的单质。写出上述反应的方程式_____
_______。
(5)、若已知原子结构规律不变,则第166号新元素在元素周期表中位置: 。
[答案]
(1)+26 2 8 14 2
(2)b
(3)NnHn+2
(4)3NaBrO3+XeO3=3NaBrO4+Xe
(5)、八VIA
18.(10分)已知a、b、c是中学教材中常见的三种物质。具有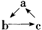 的转化关系。(“→”表示在一定条件下可
的转化关系。(“→”表示在一定条件下可 一步达成)
一步达成)
(1)下列各组物质中,可以按上述关系相互转化的是 (填选项字母)
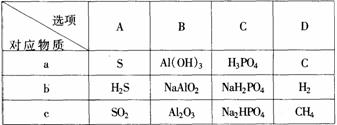
写出B项中a→b的离子反应方程式
(2)若a、b、c为均含有两个碳原子的有机物,则三种物质的结构简式可以是: a 、b 、c (3分)
(3)除(1)(2)小题所涉及的关系组外,请再举一组能体现上述三者关系的三种物质的化学式:
a 、b 、c (3分)
[答案](合理答案都给分)
(1)A、C、D Al(OH)3+OH-=AlO2-+2H2O (2)a、CH3CHO b、CH3CH2OH c、CH2=CH2 或a、CH2=CH2 b、CH3CH2Br c、CH3CH2OH (3)a、NO b、NO2 c、HNO3 或a、Fe b、FeCl2 c、FeCl3
17.(10分)在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:
C(s)+H2O(g)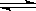 CO(g)+H2(g)
CO(g)+H2(g)
试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是 (选填序号)。
A 体系的压强不再发生变化 B v正(CO)=v逆(H2O)
C 生成n molCO的同时生成n mol H2 D 1mol H-H键断裂的同时断裂2mol H-O键
(2)若上述化学平衡状态从 正反应开始建立,达到平衡后,给平衡体系加压(缩小容积、其它条件不变。下同),则容器内气体的平均相对分子质量面将 (填写不变、变小、变大)。
正反应开始建立,达到平衡后,给平衡体系加压(缩小容积、其它条件不变。下同),则容器内气体的平均相对分子质量面将 (填写不变、变小、变大)。
(3)若上述化学平衡状态从正、逆两反应同时建立[即起始时同时投放C(s)、H2O(g)、CO(g)、H2(g)],达到平衡后,试讨论:
①容积内气体混合物的平均相对分子质量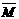 的取值范围是
。
的取值范围是
。
②若给平衡体系加压,请参照起始投放的气体物质的平均相对分子质量(设定为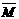 1),分别给出
1),分别给出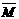 的变化:(填“增大”、“减小”、“不变”)
的变化:(填“增大”、“减小”、“不变”)
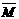 1的取值 1的取值 |
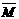 的变化 的变化 |
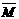 1<12 1<12 |
|
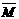 1=12 1=12 |
不变 |
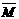 1>12 1>12 |
|
[答案](1)B、D
(2)变大
(3)①2<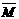 <28
②若
<28
②若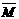 1<12,则
1<12,则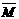 变小;;
变小;;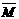 1>12则
1>12则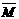 变大。
变大。
16.a mol FeS与b mol FeO投入到VL、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④Vc-(9a+b)/3mol
A.①④ B.②③
C.①③ D.②④ [答案]D
第Ⅱ卷
(本卷包括5小题,共52分)
15. 某温度下,甲、乙两个烧杯中各盛有100g相同浓度的KCl溶液,现将甲杯蒸发35g水,析出晶体5g;乙烧杯蒸发45g水,析出晶体10g。则原溶液需蒸发多少克水才恰好达到饱和?
A、10g B、15g C、20g D、25g
[答案]D
13.
|
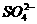 的物质的量浓度为6mol·L-1,则此溶液最多溶解铁粉的质量为( )
的物质的量浓度为6mol·L-1,则此溶液最多溶解铁粉的质量为( )
A.5.6 g B.11.2g C.22.4g D.33.6g [答案]C
14下列物质中,既能与NaOH溶液反应,又能与HNO3反应,还能水解的是
①Al2O3 ②H2S ③NaHS ④氨基酸 ⑤对-羟基苯甲酸钠 ⑥乙醇 ⑦纤维素 ⑧蛋白质
A ③④⑤⑥⑦⑧ B ③⑤⑧ C ③⑤⑥⑦⑧ D 全部 [答案]B
12.下图两个装置中,液体体积均为200 mL, 开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间
开始工作前电解质溶液的浓度均为0.5 mol/L,工作一段时间
后,测得有0.02 mol电子通过,若忽略溶液体积的变化,下列叙述正确的是()
 A.产生气体体积 ①=②
A.产生气体体积 ①=②
B.①中阴极质量增加,②中正极质量减小
C.电极反应式:①中阳极:4OH- - 4e- = 2H2O+O2↑
②中负极:2H++2e-=H2↑
D.溶液的pH变化:① 减小,② 增大
[答案]D
11.由NaHS、MgSO4、NaHSO3组成的混合物中,已知S元素的质量分数w(S)=a%,则O元素的质量分数w(O)为
A 1.75a% B 1-1.75a% C 1.25a% D 无法计算 [答案]B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com