
题目列表(包括答案和解析)
20.(20分)
(I)多项选择题(6分)
下列有关石油化工的说法正确的是
 A.通过裂化把沸点不同的物质分离开来,是物理变化
A.通过裂化把沸点不同的物质分离开来,是物理变化
B.裂解是深度裂化,目的是获得以短链不饱和烃为主要成分的基本化工原料
C.催化重整就是在催化剂的作用下,使汽油中烃分子的结构进行重新排列形成新的分子结构,以提高汽油的品质
D.利用共聚技术可以改进高分子材料的性能
(II)(14分)请回答氯碱工业中的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k =
(要求写出计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、 等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是
(填序号);
等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是
(填序号);
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
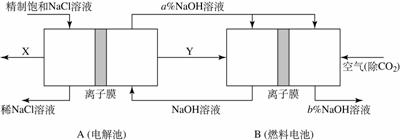
① 图中X、Y分别是 、 (填化学式),分析比较图示中氢氧化钠质量分数a %与b %的大小 ;
② 分别写出燃料电池B中正极、负极上发生的电极反应
正极: ;负极: ;
③ 这样设计的主要节(电)能之处在于(写出2处) 、 。
2010年3月海口崇雅高考文化补习学校月考化学试题
19.(20分)
(I)多项选择题(6分)
胆矾CuSO4×5H2O可写成[Cu(H2O)4]SO4×H2O,其结构示意图如下:
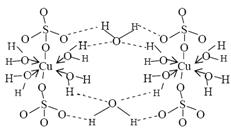
下列说法正确的是 (填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.上述结构示意图中存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
E.胆矾属于混合物
(II)(14分)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为 ,该元素的符号是 ;
(2)Y元素原子的价层电子的轨道表示式为 ,该元素的名称是 ;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为 ;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是 ;
(5)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由 。
18.(20分)
(I)多项选择题(6分)
有关下图所示化合物的说法正确的是
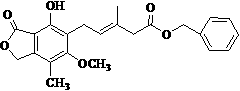
A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
 B.1 mol该化合物最多可以与3 mol NaOH 反应
B.1 mol该化合物最多可以与3 mol NaOH 反应
C.既可以催化加氢,又可以使酸性KMnO4溶液褪色
D.既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
E.此化合物属于芳香烃类化合物
(II)(14分)
已知化合物A中各元素的质量分数分别为C 37.5%,H 4.2% 和O 58.3%。请填空:
(1)0.01 mol A在空气中充分燃烧需消耗氧气1. 01 L(标准状况),则A的分子式是 ;
(2)实验表明:A不能发生银镜反应。1mol A 与足量的碳酸氢钠溶液反应可放出3mol 二氧化碳。在浓硫酸催化下,A与乙酸可发生酯化反应。核磁共振氢谱表明A分子中有4个氢处于完全相同的化学环境。则A的结构简式是 ;
(3)在浓硫酸催化和适宜的反应条件下,A与足量的乙醇反应生成B(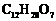 ),B只有两种官能团,其数目比为3∶1。由A生成B的反应类型是
,该反应的化学方程式是
;
),B只有两种官能团,其数目比为3∶1。由A生成B的反应类型是
,该反应的化学方程式是
;
(4)A失去1分子水后形成化合物C,写出C的两种可能的结构简式及其官能团的名称① ;② 。
17. A、B、C、D、E均为有机化合物,它们之间的关系如图所示(提示:RCH=CHR¢在酸性高锰酸钾溶液中反应生成RCOOH和R¢COOH,其中R和R¢为烷基)。
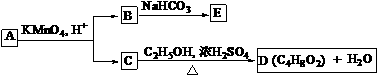
回答下列问题:
(1)直链化合物A的相对分子质量小于90,A 分子中碳、氢元素的总质量分数为0.814,其余为氧元素,则A的分子式为 ;
(2)已知B与NaHCO3溶液完全反应,其物质的量之比为1 : 2,则在浓硫酸的催化下,B与足量的C2H5OH发生反应的化学方程式是 ,反应类型为 ;
(3)A可以与金属钠作用放出氢气,能使溴的四氯化碳溶液褪色,则A的结构简式是 ;
(4)D的同分异构体中,能与NaHCO3溶液反应放出CO2的有 种,其相应的结构简式是 。
16.下表是稀硫酸与某金属反应的实验数据:
|
实验 序号 |
金属 质量 |
金属状态 |
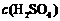 / /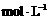 |
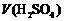 / / |
溶液温度/℃ |
金属消失 的时间/s |
|
|
反应前 |
反应后 |
||||||
|
1 2  3 34 5 6 7 8 9 |
0.10 0.10 0.10 0.10 0.10 0.10 0.10 0.10 0.10 |
丝 粉末 丝 丝 粉末 丝 丝 丝 丝 |
0.5 0.5 0.7 0.8 0.8 1.0 1.0 1.1 1.1 |
50 50 50 50 50 50 50 50 50 |
20 20 20 20 20 20 35 20 30 |
34 35 36 35 36 35 50 34 44 |
500 50 250 200 25 125 50 100 40 |
分析上述数据,回答下列问题:
(1)实验4和5表明, 对反应速率有影响, 反应速率越快,能表明同一规律的实验还有 (填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ,其实验序号是 。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因: 。
15.
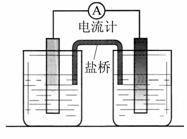
依据氧化还原反应:2Ag+(aq) + Cu (s) = Cu2+(aq) + 2Ag (s) 设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;
X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。
14.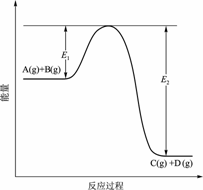 反应A(g) + B(g)
反应A(g) + B(g) C(g) + D(g)过程中的能量变化如图所示,回答下列问题。
C(g) + D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是 反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率
(填“增大”“减小”“不变”),
原因是 ;
(3)反应体系中加入催化剂对反应热是否有影响? ,原因是 ;
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 ,E2 (填“增大”“减小”“不变”)。
13. 有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。

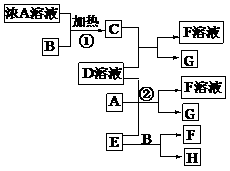
请回答下列问题:
(1)反应①的化学方程式为 ;
(2)反应②的离子方程式为 ;
(3)写出另外一种实验室制取H的化学方程式 ;
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的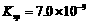 。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为
。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为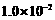
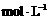 ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
。
,则生成沉淀所需Pb(NO3)2溶液的最小浓度为
。
12.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
① ; ②
; ②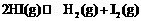
达到平衡时,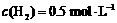 ,
,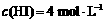 ,则此温度下反应①的平衡常数为
,则此温度下反应①的平衡常数为
A.9 B.16 C.20 D.25
第Ⅱ卷
本卷包括必考题和选考题两部分。第13题-第17题为必考题,每个试题考生都必须做答。第18题-第20题为选考题,考生根据要求做答。
11.硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下。下列说法正确的是
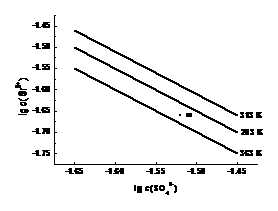
A.温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
B.三个不同温度中,313 K时Ksp(SrSO4)最大
C.283 K时,图中a点对应的溶液是不饱和溶液
D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com