
题目列表(包括答案和解析)
16.(1)△H = kJ·mol-1
(2)电池正极反应方程式: ;
负极反应方程式: 。
(3) K1= 。
(4) c(H2CO3) c(CO32-)(填“>”、“=”或“<”),
原因是
20.(Ⅰ)糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志。长期摄人高热量食品和缺少运动都易导致糖尿病。
(1)血糖是指血液中的葡萄糖(C6H12O6)。下列说法正确的是 (填字母序号)。
A.葡萄糖属于碳水化合物,分子可表示为C6(H2O)6,则每个葡萄糖分子中含6个H2O
B.糖尿病人尿糖也高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
C.葡萄糖可用于制镜工业
D.淀粉水解的最终产物是葡萄糖
(2)糖尿病人不可饮酒,酒精在肝脏内可被转化成有机物M。M的实验结果如下:
①通过样品的质谱测得M的相对分子质量为60。
②核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:乙醇(CH3CH2OH)有三种氢原子(图1)。经测定,有机物M的按磁共振氢谱示意图如下图2。
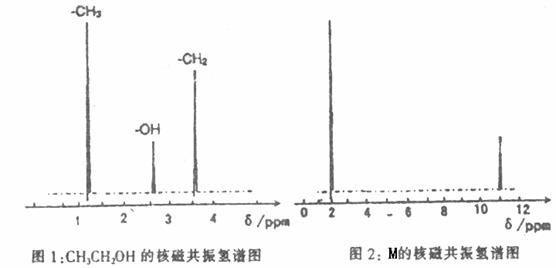
③将M溶于水,滴入石蕊试液,发现溶液变红。试推导写出M的结构简式为 。
(Ⅱ)已知物质A显酸性,F为七原子组成的环状结构,请根据以下框图回答问题:
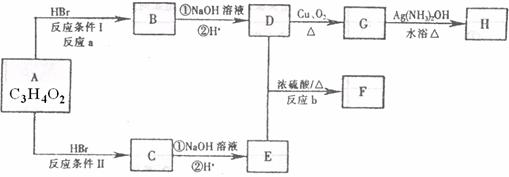
(1) A、H的结构简式为 、 。
(2)a、b的反应类型分别为 、 。
(3)D和E生成F的化学方程式 。
(4)写出C的同分异构体中属于酯类物质的结构简式 、 (任写2种)。
|
19.单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
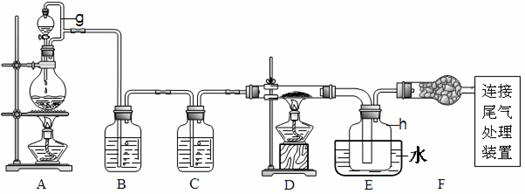
相关信息如下:①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见下表:
|
物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
|
沸点/℃ |
57.7 |
12.8 |
- |
315 |
- |
|
熔点/℃ |
-70.0 |
-107.2 |
- |
- |
- |
|
升华温度/℃ |
- |
- |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式_____________________________________。
(2)装置A中g管的作用是______________;装置C中的试剂是____________;
装置E中的h瓶需要冷却的理由是__________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的元素是_____________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
5Fe2++MnO4-+8H+====5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?___(填“是”或“否”),请说明理由_________________
②某同学称取5.000g残留物后,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000×10-2 mol/L KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是_______________。
17.下表是元素周期表的一部分.
族
 周期 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
1 |
① |
|
|||||
|
2 |
② |
③ |
④ |
|
⑤ |
⑥ |
|
|
3 |
|
⑦ |
⑧ |
|
|
⑨ |
⑩ |
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)
(2) 某元素原子的核外电子层中L层电子数比K层电子数多3,则该元素的元素符号是 ,其单质的电子式为
.
某元素原子的核外电子层中L层电子数比K层电子数多3,则该元素的元素符号是 ,其单质的电子式为
.
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的化学方程式:
;
又如表中与元素⑦的性质相似的不同族元素是 (填元素符号)
(4)元素⑤的氢化物是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g)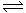 2NH3(g) △H= -92.4kJ/mol,他因此获得了1918年诺贝尔化学奖。试回答下列问题:
2NH3(g) △H= -92.4kJ/mol,他因此获得了1918年诺贝尔化学奖。试回答下列问题:
①合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)
A.采用较高压强(20Mpa~50Mpa)
B.采用500℃的高温
C.用铁触媒作催化剂
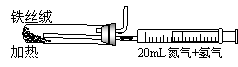 D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
②右图是实验室模拟工业法合成氨的简易装置。
简述检验有氨气生成的方法 。
③在298K时,将10 mol N2和30 mol H2放入合成塔中,为何放出的热量小于924kJ?
。
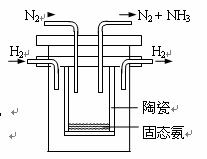
④1998年希腊亚里斯多德大学的Marmellos和Stoukides发明一种合成氨的新方法。在常压下,将H2与用He稀释的N2分别通入一加热到570℃的,以锶-铈-钇-钙钛矿多孔陶瓷(SCY)为固体电解质的电解池中转化为氨气(SCY陶瓷能传递H+),H2转化率达到78%。其实验装置如图所示。
阴极的电极反应式
。
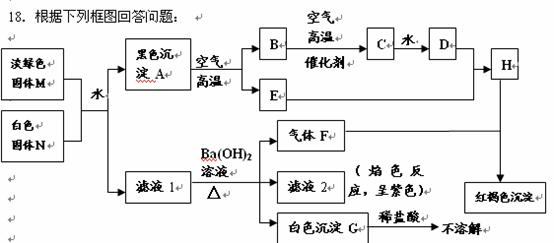
已知白色固体N中阴、阳离子具有相同的核外电子层结构。
(1)写出M中存在的离子:
(2) 请写出M与N反应的离子方程式: 。
(3)写出A在空气中锻烧的化学方程式: 。
(4)某同学取H的溶液,通入气体B,所得溶液中仍只有一种阴离子。请写出上
述变化过程中的离子方程式 。
16.北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g) ==== CH4(g)+HC≡CH(g)+H2(g) △H1= +156.6 kJ·mol-1
CH3CH=CH2(g) ==== CH4(g)+HC≡CH(g) △H 2= +32.4 kJ·mol-1
则相同条件下,反应C3H8(g) === CH3CH=CH2(g)+H2(g)的△H = kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,其电解质溶液是氢氧化钾溶液。电池正极反应方程式为: ;负极反应方程式: 。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,得到c(H2CO3)=1.5×10-5 mol·L-1的溶液,测得该溶液的pH=5.60。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1= 。(已知
HCO3-+H+的平衡常数K1= 。(已知
10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1 NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。
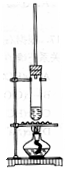
15.1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温
度为115-125℃,反应装置如右图。下列对该实验的描述错误的是( )
A.不能用水浴加热。
B.长玻璃管起冷凝回流作用。
C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤。
D.加入过量乙酸可以提高1-丁醇的转化率。
14.下列能实现的变化是( )
 A.H2SO3+ X2
+H2O=2HX + H2SO4(X2表示Cl2、Br2、I2)
B.热的浓H2SO4都能与A反应生成AO2 (A表示C、S)
C.M
+S
A.H2SO3+ X2
+H2O=2HX + H2SO4(X2表示Cl2、Br2、I2)
B.热的浓H2SO4都能与A反应生成AO2 (A表示C、S)
C.M
+S  MS(M表示Zn、Fe、Cu)
D.M+
2H2SO4=MSO4 +SO2↑
+2H2O(M表示Zn、Fe、Cu)
MS(M表示Zn、Fe、Cu)
D.M+
2H2SO4=MSO4 +SO2↑
+2H2O(M表示Zn、Fe、Cu)
13.某探究小组利用丙酮的溴代反应(CH3COCH3+Br2 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
|
实验 序号 |
初始浓度c/mol·L-1 |
溴颜色消失 所需时间t/s |
||
|
CH3COCH3 |
HCl |
Br2 |
||
|
① |
0.80 |
0.20 |
0.0010 |
290 |
|
② |
1.60 |
0.20 |
0.0010 |
145 |
|
③ |
0.80 |
0.40 |
0.0010 |
145 |
|
④ |
0.80 |
0.20 |
0.0020 |
580 |
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),v(Br2)增大 B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大 D.增大c(Br2),v(Br2)增大
12.下列实验方案能达到目的的是( )
A.除去NaCl固体中混有的MgCl2:加入KOH溶液后过滤,滤液蒸发结晶。
B.除去碳酸钠中混有的碳酸氢钠:加入过量的氢氧化钠溶液,蒸发结晶。
C.除去氢氧化镁中混有的氢氧化钙:放入水中搅拌成浆状后,加入足量氯化镁溶液,加适量水过滤洗涤。
D.除去Fe粉中混有的I2:加热使I2升华。
11.已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,
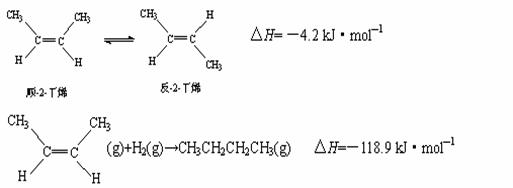
下列说法正确的是( )
A.顺-2-丁烯比反-2-丁烯稳定。
B.顺-2-丁烯的燃烧热比反-2-丁烯大。
C.加压和降温有利于平衡向生成顺-2-丁烯反应方向移动。
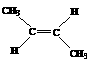 D.反-2-丁烯氢化的热化学方程式为:
D.反-2-丁烯氢化的热化学方程式为:
(g)+H2(g)→CH3CH2CH2CH3(g) △H= -123.1 kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com