
题目列表(包括答案和解析)
22.(8分)配平下列离子方程式,并回答问题:
(1)□Fe(OH)3+□ClO-+□OH-=□FeO4n-+□Cl-+□______
(2)若有3.21 g Fe(OH)3参加反应,共转移了5.418×1022个电子,则n=____,FeO4n-中铁元素的化合价为_______。
(3)试推测Fe(OH)3能与下列哪些物质反应(填序号)_________。
A.Cl2 B.SO2 C.H2S D.O2
21、一定温度下C(固)和水蒸气在密闭容器中发生反应,建立化学平衡:C(固)+H2O(气) CO(气)+H2(气);△H>0
CO(气)+H2(气);△H>0
(1)平衡混合气的平均分子量M平的取值范围为 >M平>
(2)若使用CO和H2从逆反应方向在相同温度下建立平衡,则平衡混合气的平均相对分子质量M平的取值范围为 >M平>
此时若加压,平衡将 (向左、向右、不)移动,设原平衡时混合气体中气体的物质的量共a mol ,加压、重新达到平衡后,气体比原平衡减少b mol,则新平衡时混合气平均相对分子质量M平‘与M平的关系为M平‘= (用M平、a、b的数学式表示)
(3)在(2)建立的平衡中,当①M平‘=M平时,M平= ,此时反应开始时,所用CO、H2的物质的量之比= ,②当M平< 时,M平‘<M平,③当M平> 时,M平’>M平
(4)由(3)得出结论:从逆反应方向建立平衡时,M平‘与M平的相对大小主要取决于 。
20.(10分) 下表是元素周期表的前三周期,用相应的化学用语回答下列问题:
|
|
|
|
|
|
|
|
|
|
a |
|
|
b |
c |
d |
e |
|
|
f |
|
g |
|
|
|
|
|
⑴g的单质能与f元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式 。
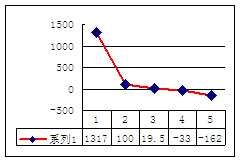
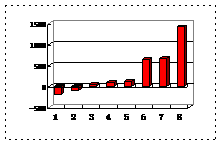
⑵第三周期8种元素按单质熔点(℃)大小顺序的柱形图(上左图),其中序列“2”代表 ,“8”代表 。
⑶a、b、c、d、e的氢化物的沸点直角坐标图(上右图),序列“5”氢化物的化学式为 ,序列“1”的氢化物的电子式: 。
19.(10分)某种晶体的晶胞为立方体,结构如右图所示: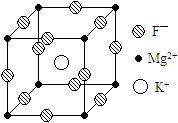
通过观察和计算,回答下列有关问题:
⑴晶体中每个Mg2+周围与它最邻近的Mg2+围成的空 间构型是 ,每个F-周围与它最邻近的K+有 个。
⑵若将该晶体重新切割晶胞,使Mg2+置于晶胞的体心,K+置于晶胞的顶点,F-应占据立方体的 位置。
⑶设该晶体的密度为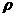 g/cm3,阿伏加德罗常数用NA表示,求算晶体中两个距离最近的Mg2+中心间距离
g/cm3,阿伏加德罗常数用NA表示,求算晶体中两个距离最近的Mg2+中心间距离
18.(11分)在常温下,取两片质量相等、外形和组成相同表面经过砂纸打磨(完全去掉了氧化物)的铝片,分别加入到盛有体积相同、 相同的稀硫酸和稀盐酸溶液的两支试管(相同体积)中,发现铝片在稀盐酸中产生氢气的速率比在稀硫酸中快。
相同的稀硫酸和稀盐酸溶液的两支试管(相同体积)中,发现铝片在稀盐酸中产生氢气的速率比在稀硫酸中快。
(1)写出以上反应的离子方程式
(2)你认为出现以上现象的可能原因是:
假设①
假设② (3)请设计实验对以上的假设进行验证:
①
②
(4)如果上述假设都成立,要使以上稀硫酸与铝反应产生的氢气速率加快,可以采取的措施有:(至少填四种)
17.(6分)⑴可以验证镁、铝的金属性强弱的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
⑵现有MgCl2溶液、AlCl3溶液、NaOH溶液、氨水、盐酸等几种物质,试设计实验方案证明镁、铝的金属性强弱。
16。某温度时,把1molN2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。则下列说法正确的是
A 前4s中以N2O4的浓度变化表示的平均反应速度为0.01mol/L·s
B 在4s时容器内的压强为开始时的1.2倍
C 在平衡时容器内含N2O40.4mol
D 在平衡时容器内含NO21.6mol
第Ⅱ卷(非选择题 共86分)
15.一定温度下,将2mol A、2mol B、2mol C的气体混合物充入一体积不变的密闭容器中,充分反应后恢复到起始温度,测得容器内的压强比起始时增大了20%,则容器中可能发生的反应是
A.2A+B 2C B.A+B
2C B.A+B 2C
2C
C.2A+B C D.A+B
C D.A+B 3C
3C
14.T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
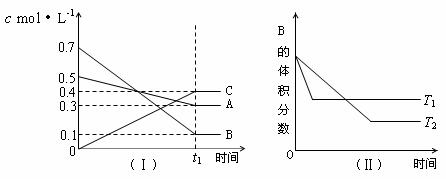
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.(t1+10)min时,保持容器体积不变,通入稀有气体,平衡向逆反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L-1 A、0.1 mol·L-1 B和0.4 mol·L-1 C反应,达到平衡后,C的浓度仍为0.4 mol·L-1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
13.对于平衡体系mA(g)+nB(g) pC(g)+qD(g);△H<0。下列结论中正确的是
pC(g)+qD(g);△H<0。下列结论中正确的是
A.若平衡时A、B的转化率之比为m∶n,说明反应开始时,A、B的物质的量相等
B.若温度不变,将容器的体积增大1倍,此时A的浓度变为原来的0.48倍,则m+n>p+q
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入b mol B,达到新平衡时,气体的总物质的量等于(a+b)
D.若升高温度时,平衡混合气体的平均相对分子质量增大,则m+n>p+q
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com