
题目列表(包括答案和解析)
11. 在密闭容器中,反应X2(g)+Y2(g) 2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是:
在密闭容器中,反应X2(g)+Y2(g) 2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是:
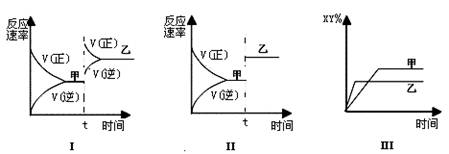
A.图Ⅰ是加入适当催化剂的变化情况 B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况 D.图Ⅲ是升高温度的变化情况
10.体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01mol,下列叙述错误的是: A.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多
 B.它们分别与足量CaCO3反应时,放出的CO2一样多
C.两种溶液的pH相同
B.它们分别与足量CaCO3反应时,放出的CO2一样多
C.两种溶液的pH相同
D.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-)
9.设NA表示阿伏加德罗常数,下列说法正确的是:
A.标准状况下1molHCl与HF的混合物的体积约为22.4L
B.0.5L0.5mol/L的NaNO3溶液中含有的粒子总数约为0.5×6.02×1023
C.常温常压下,1 mol甲基(-CH3)所含的电子数为9NA
D.9 g重水所含有的电子数为5NA
8.下列有关Cl、N、S等非金属元素化合物的说法正确的是:
A.漂白粉的成分为次氯酸钙
B. 任何铵盐加热后都有NH3放出
C.实验室可用NaOH溶液处理NO2和SO2废气
D.Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒
7.下列属于新能源的是:①天然气②煤③海洋能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
A.①②③④ B.③⑤⑥⑦⑧ C.①③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
30.(17分)如下图所示,A、B、C、D、E、F、C均为有机物,它们之间有如下转化关系(部分产物和反应条件已略去)。已知B分子中 含有苯环,其蒸气密度是同温同压下H2密度的59倍,1molB最多可以和4
mol H2发生加成反应,B的苯环上的一个氢原子被硝基取代所得的产物有三种。E和G都能够发生银镜反应。F分子中
含有苯环,其蒸气密度是同温同压下H2密度的59倍,1molB最多可以和4
mol H2发生加成反应,B的苯环上的一个氢原子被硝基取代所得的产物有三种。E和G都能够发生银镜反应。F分子中 含有羟基和羧基,在一定条件下可以聚合生成高分子化合物。
含有羟基和羧基,在一定条件下可以聚合生成高分子化合物。

请回答下列问题:
(1)A、B、C的结构简式:A为_________;B为___________;C为_________。
(2)反应①的反应类型是___________;反应②的反应类型是__________;反应③的反应类型是_____________。
(3)G与银氨溶液反应的化学方程式为____________。
(4)等物质的量的A与F发生酯化反应,所生成有机物的结构简式为_________。
(5)A的一种同分异构体与浓H2SO4共热,也生成B和水,该同分异构体的结构简式为__________________.
(6)E有多种同分异构体,其中 属于酯类且具有两个对位侧链的同分异构体共有_____种。
属于酯类且具有两个对位侧链的同分异构体共有_____种。
29.(14分)某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。
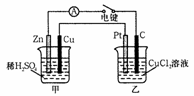
请回答下列问题:
(1)甲装置的名称是____________;乙装置的名称是___________;Zn为_________极;Pt为_____________极。
(2)写出电极反应式:Cu极____________;C极_____________。
(3)当甲中 产生0.1
mol气体时,乙中
产生0.1
mol气体时,乙中 析出铜的质量应为____________;乙中
析出铜的质量应为____________;乙中 产生的气体在标准状况下的体积应为______________。
产生的气体在标准状况下的体积应为______________。
(4)若乙中 溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中
溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中 溶液的颜色___________(填“变深”、“变浅”或“无变化”)。
溶液的颜色___________(填“变深”、“变浅”或“无变化”)。
(5)若乙中 电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中
电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中 溶液的pH将___________(填“增大”、“减小”或“不变”,下同);乙中
溶液的pH将___________(填“增大”、“减小”或“不变”,下同);乙中 溶液的pH将__________。
溶液的pH将__________。
(6)如果乙中 电极不变,将其溶液换成饱和Na2SO4溶液,电键闭合一段时间,当阴极上有a
mol气体生成时,同时有wg
Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中
电极不变,将其溶液换成饱和Na2SO4溶液,电键闭合一段时间,当阴极上有a
mol气体生成时,同时有wg
Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中 溶质的质量分数应为____________(用含w、a的表达式表示,不必化简)。
溶质的质量分数应为____________(用含w、a的表达式表示,不必化简)。
28.(17分)某研究性学习小组的同学用以下仪器组合的装置制取氯气,并探究其性质。
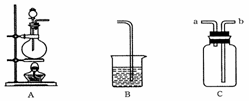
请回答下列问题:
(1)实验室制取氯气的化学方程式为__________________________________;检查上图中 反应器A的气密性的方法是_________________________________。
反应器A的气密性的方法是_________________________________。
(2)现要求从上图中 选用所需的仪器(可重复选用)组成一套制取纯净、干燥氯气的装置,实验时要防止污染。下表是按仪器的连接顺序由上至下依次填写的,请将该表填写完整。(加入的试剂自选)
选用所需的仪器(可重复选用)组成一套制取纯净、干燥氯气的装置,实验时要防止污染。下表是按仪器的连接顺序由上至下依次填写的,请将该表填写完整。(加入的试剂自选)
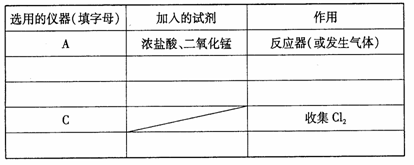
(3)该实验中 用仪器C收集Cl2时,进气口应为__________(填字母)。
用仪器C收集Cl2时,进气口应为__________(填字母)。
(4)将氯气通入到紫色石蕊溶液中 ,可观察到溶液先变红后褪色的现象,出现这种现象的原因是____________________________________________________。
,可观察到溶液先变红后褪色的现象,出现这种现象的原因是____________________________________________________。
(5)有资料记载,高锰酸钾和浓盐酸混合后,在室温下很快就能放出氯气,由此可说明二氧化锰比高锰酸钾的氧化性__________________________。
(6)人若吸入大量氯气会中 毒死亡。某地化工厂的贮氯罐意外发生泄漏,周围被疏散的群众应采取的防御自救措施是________________________________。
毒死亡。某地化工厂的贮氯罐意外发生泄漏,周围被疏散的群众应采取的防御自救措施是________________________________。
27.(12分)现有前4周期中 的A、B、C、D、E五种主族元素。A元素在其氧化物AO3中
的A、B、C、D、E五种主族元素。A元素在其氧化物AO3中 的质量分数为40%,A原子中
的质量分数为40%,A原子中 质子数与中
质子数与中 子数相等;B是同周期中
子数相等;B是同周期中 除稀有气体外原子半径最大的元素;D能形成BD型离子化合物,且B和D的离子的电子层结构相同;C和D能形成CD3的化合物;C原子比E原子多1个电子;0.9 g C与足量的稀硫酸反应,所产生的氢气在标准状况下的体积为1.12 L;C原子中
除稀有气体外原子半径最大的元素;D能形成BD型离子化合物,且B和D的离子的电子层结构相同;C和D能形成CD3的化合物;C原子比E原子多1个电子;0.9 g C与足量的稀硫酸反应,所产生的氢气在标准状况下的体积为1.12 L;C原子中 质子数比中
质子数比中 子数少1;D原子比A原子多1个质子。请回答下列问题:
子数少1;D原子比A原子多1个质子。请回答下列问题:
(1)写出元素符号A_________;B__________;C_________;D_________;E_________。
(2)A-E五种元素中 ,单质还原性最强的是___________;最高价氧化物对应水化物中
,单质还原性最强的是___________;最高价氧化物对应水化物中 酸性最强的是______________(写化学式)。
酸性最强的是______________(写化学式)。
(3)B与D形成的化合物的电子式为______________。
(4)E能在二氧化碳中 燃烧,有关反应的化学方程式为_____________。
燃烧,有关反应的化学方程式为_____________。
(5)B、C元素的最高价氧化物的水化物之间反应的离子方程式为____________。
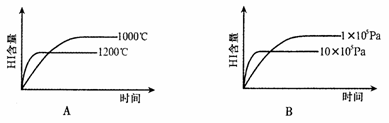
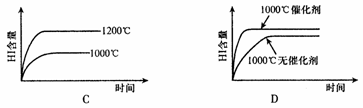
13.已知:H2(g)+I2(g) 2HI(g),△H<0,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图正确的是
2HI(g),△H<0,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图正确的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com