
题目列表(包括答案和解析)
8.用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
B.标准状况下,22.4L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32-
7.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2
+ 3C  2AlN + 3CO
2AlN + 3CO
下列叙述正确的是( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体
6.《中华人民共和国食品安全法》于2009年6月1日起实施。下列做法不利于食品安全的是( )
A.用聚氯乙烯塑料袋包装食品
B.在食盐中添加适量的碘酸钾
C.在食品加工中科学使用食品添加剂
D.研发高效低毒的农药,降低蔬菜的农药残留量
31.设空气中N2、O2的体积分数分别为0.8和0.2。在沸腾炉中将硫铁矿用空气中充分煅烧:
4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(1)所得气体中SO2的体积分数不超过 %(保留一位小数)。
(2)若从接触室出来的气体中SO2、O2、N2、SO3的体积比为0.5:1:20:x,则x= ,此时反应中SO2的转化率为 %(保留一位小数)。
(3)在实际生产中,在接触室SO2与O2的体积比以1︰4较为适宜。若沸腾炉通入接触室的炉气中SO2、O2、N2的体积比为8:1:48,其流速为2.5m3/s, 则再往接触室里通入的空气的流速应为 m3/s(保留一位小数;气体体积在同温同压下测定)。
(4)从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物。取不同质量的铵盐,分别加入x mol/L的50.00mL NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收。实验数据如下:
|
实验次数 |
铵盐质量(g) |
浓硫酸增加的质量(g) |
|
第一次 |
1.570 |
0.340 |
|
第二次 |
3.140 |
0.680 |
|
第三次 |
4.710 |
0.510 |
|
第四次 |
6.280 |
0 |
①该铵盐中(NH4)2SO3和NH4HSO3的物质的量之比为 。
②试求x的值:
静安区2009学年第二学期高三年级教学质量检测
30. CoCl2•xH2O与Na2CO3•10H2O的固体混合物共8.100g,加入足量的水后,生成白色的碳酸钴沉淀,将沉淀滤出,洗净烘干,其质量为1.190g。将滤液与洗涤液合并,加入足量盐酸产生无色气体0.224L(不考虑气体的溶解)。
(1)固体混合物中Na2CO3•10H2O的质量为_______ g(保留2位小数)。
(2)CoCl2•xH2O 中x=_____。
(3)将得到的1.190g沉淀在空气中充分灼烧至恒重,得到的固体是一种钴的氧化物,其质量为0.830g,该氧化物属离子晶体。通过计算,可确定该晶体的化学式为 。
29.在一定条件下有反应:C6H5OH +CH3I → C6H5OCH3 + HI
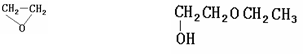 +CH3CH2OH →
+CH3CH2OH →
环氧树脂是一类性能优良、使用广泛的聚合物,合成过程可表示如下(反应条件均略去):
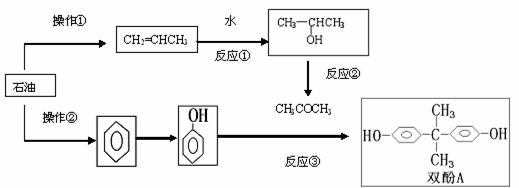
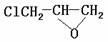 双酚A与(环氧氯丙烷)在一定条件下制得环氧树脂:
双酚A与(环氧氯丙烷)在一定条件下制得环氧树脂:
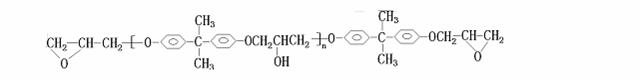 (1)操作①是
;操作②是 (选填序号)
(1)操作①是
;操作②是 (选填序号)
a.分馏 b.裂化 c.裂解
(2)反应①是 ;反应②是 (填反应类型)。
(3)完成反应③的化学方程式: 。
(4)在生成环氧树脂的同时还有 生成。
(5)环氧树脂两端的环氧键可与某些物质反应,使链与链连接起来,这种物质可以是 (填序号) a.乙醇 b.乙二醇 c.1-丙醇
(6)环氧氯丙烷有多种同分异构体,其中能起银镜反应的有 种,写出其中一种的系统命名 ;若双酚A中的H原子被1个D原子取代,则取代的产物有 种。
(7)工业上由苯制取苯酚有多种方法,如:
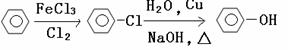
方法一:

方法二:
方法二优于方法一之处有: (答一点即可)。
28.  A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
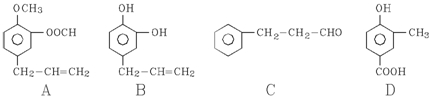



 请回答下列问题:
请回答下列问题:
 (1)写出B中官能团的名称
;1mol B能与含____molBr2的溴水反应。
(1)写出B中官能团的名称
;1mol B能与含____molBr2的溴水反应。
 (2)既能使FeCl3溶液显紫色又能和NaHCO3溶液反应放出气体的是
(用A、B、C、D填空)。
(2)既能使FeCl3溶液显紫色又能和NaHCO3溶液反应放出气体的是
(用A、B、C、D填空)。
 (3)按下图C经一步反应可生成E,E是B的同分异构体,则反应①属于
反应(填反应类型名称);酯F分子中共有11个碳原子,写出反应②的化学方程式
。
(3)按下图C经一步反应可生成E,E是B的同分异构体,则反应①属于
反应(填反应类型名称);酯F分子中共有11个碳原子,写出反应②的化学方程式
。



 (4)同时符合下列两项要求的D的同分异构体有4种:
(4)同时符合下列两项要求的D的同分异构体有4种:
 ①都是苯的1,2-二取代物;
①都是苯的1,2-二取代物;
 ②两个取代基分别为-OH和含有-COO-结构的基团
②两个取代基分别为-OH和含有-COO-结构的基团
 其中两种(G和H)结构简式如下图所示,请补充另外两种。
其中两种(G和H)结构简式如下图所示,请补充另外两种。





 、
_____________________。
、
_____________________。
 (5)写出H与足量NaOH溶液共热反应的化学方程式
(5)写出H与足量NaOH溶液共热反应的化学方程式
___________________________________________________________。
27.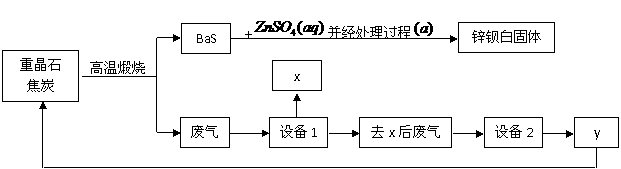 锌钡白是BaSO4和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程:
锌钡白是BaSO4和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程:
请根据上述流程回答下列问题:
(1)重晶石的化学式为_______,锌钡白可用于调制_____色和浅色油漆。
(2)处理过程 的步骤为:①_________;②洗涤;③______________。
的步骤为:①_________;②洗涤;③______________。
(3)设备1是冷却分离塔,若设备1前面的导气管过长、过窄,可能使导气管堵塞,其原因是 。
(4)检验锌钡白中含有S2-的方法是 。
(5)设备2中所用的洗涤剂是NaOH溶液,则y的化学式为________。写出设备2中发生反应的离子方程式:___________________________________、_________________________________。
(6)可用 法分离溶液中的钠盐,进行分离前,需要查得的数据是 。
(7)制备过程中得到的硫磺,除了可用来制硫酸外,其它的用途为____ (至少写一种)。
26.某实验小组用氨碱法制取碳酸钠的原理,在实验室设计下列模拟装置制备NaHCO3(铁架台、C装置水浴中的温度计、酒精灯等略去),然后再制取Na2CO3。提供的试剂有:硫酸、盐酸、石灰石、浓氨水、碳酸氢钾溶液、水、生石灰、食盐等。



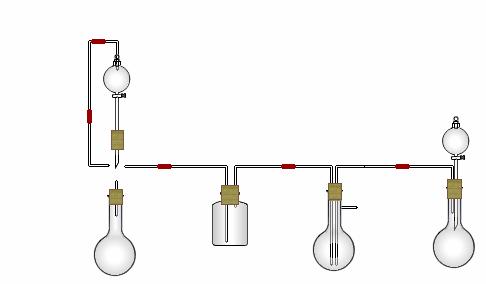
(1)在A中分液漏斗和烧瓶中加入的试剂分别是 、 ;D中分液漏斗和烧瓶中加入的试剂分别为 、 ;
(2) B中加入的试剂是 , 作用是 。
(3)写出C中生成的NaHCO3化学方程式: 。
(4)装置A中分液漏斗上方装一导管的主要作用是 。
(5)实验开始a、b两活塞的正确操作应是(选填序号) 。
①同时打开a、b两活塞 ②先打开a,后打开b ③先打开b,后打开a
(6)检验C装置溶液中生成的溶质是NaHCO3而不是Na2CO3的方法是 。
(7)由C中NaHCO3再制取Na2CO3需进行的实验操作有过滤、洗涤、 。
(8)从绿色化学角度看,这一装置的主要缺点是尾气逸出,浪费资源, 改进的方法是 。
25.工业上用CO生产燃料甲醇。一定条件下发生反应:CO (g)+2H2 (g) CH3OH (g)。
CH3OH (g)。

(1)该反应的平衡常数表达式为:K=
(2)图1是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到平衡,用CO浓度变化表示的平均反应速率v(CO)= 。
(3)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。该反应是 (填“吸热”或“放热”)反应,反应的热化学方程式是 。
(4)适宜的催化剂能 (选填序号)。
a.改变反应的热效应 b.降低生产能耗 c.加快反应速率 d.提高反应物的转化率
(5)恒容条件下,下列措施中能使n (CH3OH)/n (CO)增大的有 (选填序号)。
a. 升高温度 b. 使用催化剂 c.再充入2mol H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com