
题目列表(包括答案和解析)
30. [选修-物质结构与性质](13分)
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
A |
|
|
|||||||||||||||
|
B |
|
|
|
C |
D |
E |
F |
|
|||||||||
|
G |
H |
I |
J |
|
K |
L |
|
||||||||||
|
|
|
|
|
|
M |
|
|
N |
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素N的基态原子电子排布式 。
(2)元素B、G形成的单质熔点更高的是_______(填化学式),原因是_________________________
(3)ME2L2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断ME2L2是__________(填“极性”或“非极性”)分子。
(4)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CS2分子的空间构型是__________。
(5)元素N可以形成分子式为Co(NH3)5BrSO4,配位数均为6的两种配合物,若往其中一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则该配合物的化学式为 。
25.(16分)向草酸(H2C2O4)溶液中逐滴加入酸性高锰酸钾溶液反应时,溶液褪色总是先慢后快。为了探究此反应速率由小变大的原因,设计如下实验
已知:①MnO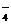 在酸性环境下的还原产物是Mn2+;
在酸性环境下的还原产物是Mn2+;
②草酸是二元弱酸,有毒,温度较高时分解。
(1)0.10mol/L H2C2O4溶液的配制:K^S*5U.C#O
实验室欲配制100mL 0.10mol/L H2C2O4 溶液,需要用托盘天平称取草酸晶体(H2C2O4·2H2O) g;实验中需要用到的玻璃仪器除了玻璃棒、胶头滴管外还有: 。(填代号)
(2)反应速率变化的探究
取4支试管,按以下四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化均如下:紫红色→红色→橙红色→橙色→黄色→无色,但溶液褪为无色所需的时间不同,如下表所示:(表中“-”表示未加入该试剂)
|
实验 编号 |
温度(利用水浴加热) |
0.10mol/L 草酸溶液 |
稀硫酸 溶液 |
MnSO4固体 |
0.10 mol/L KMnO4溶液 |
褪色 时间 |
|
1 |
65℃ |
5mL |
- |
- |
1mL |
100s |
|
2 |
65℃ |
5mL |
10滴 |
- |
1mL |
90s |
|
3 |
75℃ |
5mL |
10滴 |
- |
1mL |
40s |
|
4 |
75℃ |
5mL |
10滴 |
加入少许 |
1mL |
3s |
①H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为 ;
②设计对比实验1、2的目的是:_____________________________________________ ;
③由表中数据可以得出,温度对该化学反应速率的影响是:________________________;
为了加快该反应的反应速率,是不是水浴的温度越高越好?_______(填“是”或“否”);
④由以上4个实验,还可以得出的一个结论是:_____________________________
⑤若为了探究浓度对该反应速率的影响,则在所设计的实验中最好是增大________(填“草酸”或“高锰酸钾”)溶液的浓度,以减少实验误差。
24.(16分)以黄铜矿[主要成分是CuFeS2(Cu、Fe均为+2价),含少量杂质SiO2]为原料炼铜的方法分为高温炼铜和湿法炼铜两种。近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐:K^S*5U.C#O
4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
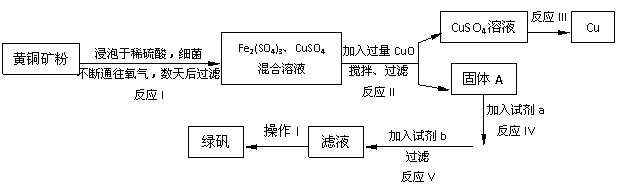 某工厂运用该原理生产铜和绿矾(FeSO4·7H2O)的工艺如下:
某工厂运用该原理生产铜和绿矾(FeSO4·7H2O)的工艺如下:
回答下列问题:
(1)在反应I中,被还原的元素是______________(填元素名称)
(2)上述反应II的目的是:____________________________________________________
固体A是______________(填“纯净物”或“混合物”)
(3)试剂a为
(4)反应III的化学方程式为:_____________________________________________
反应V的离子方程式为:_____________________________________________
(5)欲从溶液中获得绿矾晶体,分离操作Ⅰ应为 、冷却结晶、 。
23.(14分)元素化合物的知识是中学化学的重要知识,请结合有关知识回答下列问题:K^S*5U.C#O
(1)NaHCO3是发酵粉的主要成分之一,主要是利用其受热易分解的性质,请写出该反应的化学方程式:__________________________
(2)实验室储存的硝酸溶液经常显黄色,是因为溶解了__________(填物质的化学式)的缘故
(3)工业上制粗硅的方法是将硅石(SiO2)与碳在高温的条件下反应,该反应氧化剂与还原剂的物质的量之比为:______________
(4)工业上利用电解熔融的MgCl2制备金属镁,试写出其阴极反应式:_________________
(5)实验室制氯气的离子方程式为:_________________________________________
(6)高铁电池是一种新型可充电电池,其未配平的电池反应式为:
Zn+K2FeO4+H2O――Zn(OH)2+Fe(OH)3+KOH,则配平后KOH的化学计量数为
12.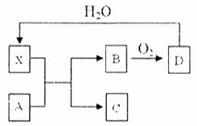 已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如下图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是:
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如下图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是:
A.X使蔗糖变黑的现象主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水,一定可以观察到白色沉淀产生
D.工业上,B转化为D的反应条件为高温、常压、使用催化剂
11.下列过程都与热量变化有关,其中表述不正确的是
A.CO(g)的燃烧热是283.0KJ/mol,则表示CO(g)燃烧反应的热化学方程式为:
CO(g)+1/2 O2(g)= CO2(g);△H=-283.0kJ/mol
B.水解反应是吸热反应,升温,水解平衡常数不变。
C.铝热反应是放热反应,但需要足够的热量才能使反应发生
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小
10.已知298K时,氨水的电离平衡常数为1.76×10-5。现向20.00mL0.1mol/L氨水中逐滴加入等物质的量浓度的盐酸,下列示意图变化趋势正确的是

9.A、B、C、D、E、F为原子序数依次增大的短周期元素,其中A与E同主族,B与F同主族,E与F同周期,已知常温下A、E单质的聚焦状态不同,D原子的核电荷数是B原子最外层电子数的2倍,F单质是一种重要的半导体材料。下列说法正确的是
A.由A、C、D三种元素组成的化合物中可能含有离子键
B.F与D形成的化合物质地坚硬,既不与酸反应也不与碱反应
C.F、C、B元素最高价氧化物对应的水化物的酸性依次增强
D.原子半径由大到小的顺序是:C>D>E>F
8.下列事实与结论相符且正确的是
A.0.1mol·L-1 AlCl3溶液中含有Al3+数目一定小于0. 1NA(NA代表阿伏加德罗常数)
B.0.1 mol·L-1 Na2CO3溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C.相同温度下,pH相等的H2SO4和盐酸稀释相同倍数之后溶液的pH一定相等
D.Ksp(BaSO4)=1.07×10-10,Ksp(BaCO3)=2.58×10-9,所以任何条件都不能将BaSO4转化为BaCO3
7.已知:含碳碳双键的物质( 如烯烃)一定条件下能与水发生加成反应,生成醇(含羟基的烃的衍生物);有机物A-D间存在图示的转化关系。下列说法正确的是
如烯烃)一定条件下能与水发生加成反应,生成醇(含羟基的烃的衍生物);有机物A-D间存在图示的转化关系。下列说法正确的是
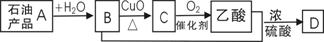
A.D结构简式为CH3C-O-OCH2CH3
B.A能使酸性高锰酸钾溶液褪色,不能使溴水因反应而褪色
|
 D.C转化为乙酸的化学方程式为:CH3CHO+O2
CH3COOH
D.C转化为乙酸的化学方程式为:CH3CHO+O2
CH3COOH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com