
题目列表(包括答案和解析)
4.下列判断中一定正确的是:
A.等物质的量的CaCl2及CaO2固体中阴、阳离子数之比均为2∶1
B.等质量的O2与O3中,氧原子的个数比为3∶2
C.分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1∶2
D.10mL 0.3mol·L-1NaCl与30mL0.1mol·L-1AlCl3溶液中Cl-物质的量浓度比为1∶3
3.如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是:
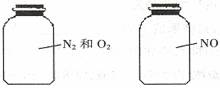

A.所含原子数相等 B.气体密度相等 C.气体质量相等 D.摩尔质量相等
2.下列判断正确的是:
A.任何溶胶加入可溶性电解质后都能使胶体粒子凝成较大颗粒形成沉淀析出
B.丁达尔现象、布朗运动、电泳现象都是胶体的物理性质
C.因为胶粒比溶液中溶质粒子大,所以胶体可以用过滤的方法把胶粒分离出来
D.相同条件下,相同溶质的溶液,饱和溶液不一定比不饱和溶液浓一些
1.下列判断正确的是:
A.酸酐一定是氧化物 B.CuSO4·5H2O是一种混合物
C.碱性氧化物一定是金属氧化物 D.正四面体分子中键角一定是109o28′
28.(20分)有机物OPP是用途十分广泛的有机化工产品,广泛应用于杀菌防腐、印染助剂、表面活性剂、稳定剂和阻燃剂等领域。以烃A为原料可合成OPP:
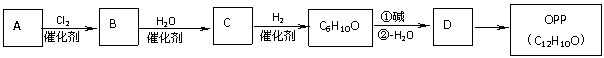
已知醛或酮在碱催化下可发生如下反应: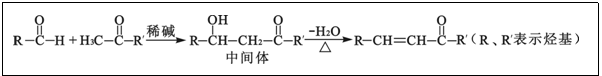


(1)①烃A是无色、带有特殊气味的液体。经实验测定,烃A中碳元素和氢元素
的质量比为mC: mH=12:1。烃A的结构简式为 。
②(填操作名称) 是分离、提纯液态有机物的常用方法,烃A就是用该方法从煤焦油中得到的基本化工原料。
(2)烃A生成有机物B的反应类型为 。
(3)①有机物C能与NaOH反应,反应的化学方程式为 。 ②有机物C与B浓溴水反应生成白色沉淀,可用于有机物C的定性检验和定
量测定,反应的化学方程式为 。
(4)有机物C6H10O的红外光谱图显示分子中含有C=O键,但是C6H10O不能发生银镜
反应。C6H10O的结构简式为 。
(5)有机物D的结构简式为 。
(6)有机物D在钯催化剂催化下进行脱氢反应得到OPP,OPP的红外光谱图显示分子中有O-H键和苯环。OPP的一种同分异构体E和OPP具有相同的基团,其核磁共振氢谱有6个峰,峰面积之比为1: 2:2:2:2:1,有机物E的结构简式
为 。
27.(16分).某课外小组在实验室制备氨气,并进行有关氨气的性质探究。
(1)该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气。
①应该选用的仪器及装置有(填字母) 。

|
|
|
|
|
|
|
|
|
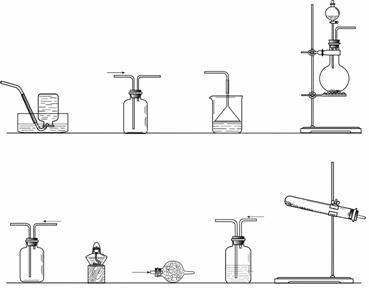
②生石灰与氯化铵反应生成氨气的化学方程式为 。
(2)该小组同学设计下图所示装置探究氨气的还原性。
|
|
|
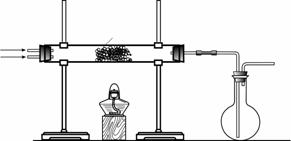
①氨催化氧化的化学方程式为 。
②若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为 。
(3)该小组同学以氨气和二氧化碳为原料制备碳酸氢铵。
①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。请选择合理的方案并说明原因。
。
②检验产物中有NH4+的方法为
。
26.(12分)近年来北京市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
 (1)汽车内燃机工作时引起反应:N2(g)+O2(g)
(1)汽车内燃机工作时引起反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数K=
。(计算结果保留小数点后两位数字)
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数K=
。(计算结果保留小数点后两位数字)
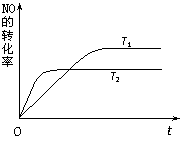
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如右图所示。(已知:T1<T2)
|
 N2(g)+O2(g)为(填“吸热”或“放热”)
反应。
N2(g)+O2(g)为(填“吸热”或“放热”)
反应。
②一定温度下,能够说明反应 2NO(g) 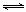 N2(g)+O2(g) 已达到平衡的是
N2(g)+O2(g) 已达到平衡的是
(填序号) 。
a.容器内的压强不发生变化
b.NO、N2、O2的浓度保持不变
c.NO分解的速率和NO生成的速率相等
d.单位时间内分解4 mol NO,同时生成2 mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2= 。
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为 。
25.(10分)从铝土矿(主要成分是Al2O3,含RO2、Fe2O3等杂质)中提取Al2O3的一种工艺流程如下:


(1)元素R位于周期表中的第三周期,其最高正化合价和负化合价的绝对值相等。RO2的用途有(写出1条即可)_______________________________________________。
(2)铝土矿加入足量烧碱溶液后主要反应的离子方程式为
①________________________________________________________。
②________________________________________________________。
(3)工业上通过电解氧化铝和冰晶石的熔融液来冶炼金属铝。已知电极材料为惰性材料,阳极反应式为______________________________。
(4)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X。已知每转移3 mol e-,有1.5 mol化合物X生成,此反应的化学方程式______________________________________。
12.下列说法正确的是
A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:
4Mg + 6H+ + NO3-= 4Mg 2+ + NH4+ + 3H2O
B.25 ℃时,将20 mL 0.1 mol·L-1 H2SO4溶液和30 mL 0.15 mol·L-1 NaOH溶液混合,若混合后溶液体积不变,则混合溶液的pH为11
C.将10 mL 0.1 mol·L-1 KAl(SO4)2溶液和10 mL 0.2 mol·L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2
D.浓度均为0.1 mol·L-1的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系:c(CH3COOH) + 2c(H+) =c(CH3COO-)+ 2c(OH-)
11.已知: H2(g)+ 1/2O2(g)=H2O(l) ΔH = -285.8 kJ·mol-1
CH4(g)+ 2O2(g)=CO2(g)+2H2O(l) ΔH = -890.3 kJ·mol-1
现有H2和CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5 kJ,则原混合气体中H2合CH4的物质的量之比是
|
A.1∶1 |
B.1∶3 |
C.1∶4 |
D.2∶3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com