
题目列表(包括答案和解析)
14. 设阿伏加德罗常数为NA。则下列说法正确的是:
A. 常温常压下,6 g 24He所含有的中子数目为2NA
B. 标准状况下,0.3 mol二氧化硫中含有氧原子数为0.3NA
C. 常温下,2.7 g铝与足量的盐酸反应,失去的电子数为0.3NA
D. 常温下,1 L 0.1 mol/L MgCl2溶液中含Mg2+数为0.1NA
13.某溶液中含有NO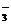 、SiO
、SiO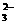 、AlO
、AlO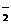 、CO32-等四种阴离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的NaOH溶液,则溶液中大量减少的阴离子是:
、CO32-等四种阴离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的NaOH溶液,则溶液中大量减少的阴离子是:
A.NO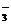 B.SiO
B.SiO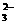 C.AlO
C.AlO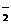 D.CO32-
D.CO32-
12.下列说法可以实现的是:
①酸性氧化物在一定条件下均能与碱发生反应
②弱酸与盐溶液反应可以生成强酸
③发生复分解反应,但产物既没有水生成,也没有沉淀和气体生成
④两种酸溶液充分反应后,所得溶液呈中性
⑤有单质参加的反应,但该反应不是氧化还原反应
A.①②③④⑤ B.只有①②④⑤
C.只有③④⑤ D.只有②④⑤
11.能在溶液中大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后仍能大量存在的离子组是:
A.Na+、H+、Cl-、NO3- B.K+、Ba2+、OH-、I-
C.Na+、Mg2+、Cl-、SO42- D.Cu2+、S2-、Br-、ClO-
10.已知:①I2+SO2+2H2O=2HI+H2SO4;②2FeCl2+Cl2=2FeCl3;
③2FeCl3+2HI=2FeCl2+2HCl+I2根据上面反应判断,下列说法正确的是:
A.氧化性强弱顺序是:Fe3+ > SO2> I2 > SO42-
B.还原性强弱顺序是:SO2> I-> Fe2+>Cl-
C.反应Cl2+SO2+2H2O=2HCl+H2SO4不能发生
D.Fe3+与I-在溶液可以大量共存
9.在下列各溶液中,离子一定能大量共存的是:
A.强碱性溶液中:K+、CO32-、Cl-、SO42-
B.含有0.1 mol·L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3-
C.无色透明溶液中:H+、Cl-、K+、Cr2O72-
D.在加入金属Al产生H2的溶液中:Ag+、K+、NO3-、Na+
8.下列反应的离子方程式中正确的是:
A.向Ba(OH)2溶液中加入过量:NaHSO4溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O
B.FeBr2 溶液中通入过量:Cl2 Fe2++ Cl2 = Fe3+ + 2Cl―
C.用氨水吸收过量的SO2:NH3·H2O+SO2=NH+4+HSO3-
D.氢氧化铁溶于碘化氢溶液 :Fe(OH)3+3H+==Fe3++3H2O
7.将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O═SO42-+2Fe2++4H+, Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,有关说法正确的是:
A.还原性Cr3+ >Fe2+>SO2 B.氧化性Cr2O72->SO2>Fe3+
C.两个反应中Fe2(SO4)3均作还原剂 D.Cr2O72-能将Na2SO3氧化成Na2SO4
6. 设NA表示阿伏加德罗常数 ,下列叙述中正确的是:
,下列叙述中正确的是:
A.标准状况下,NA个SO3分子所占的体积约为22.4 L
B.7 g CnH2n中含有的氢原子数目为NA
C.1.8 g重水(D2O)中所含质子的个数为NA
D.在反应CaO+3C CaC2+CO↑中,生成1 mol CO,转移的电子数为3NA
5. 分类方法在化学学科的发展中起到了非常重要的作用。下列分类的标准合理的是: ①根据化合物中是否含有碳元素,将化合物分为有机物和无机物 ②根据酸分子中含有的氢原子的个数将酸分为一元酸,二元酸等 ③根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 ④根据分散系是否具有丁达尔现象将分散系分为溶液,胶体和浊液 ⑤根据化学反应中的热效应将化学反应分为吸热反应和放热反应 ⑥根据氧化物的组成将氧化物分为酸性,碱性和两性氧化物 A.①②④ B.③⑤ C.①②③⑤ D.③④⑤⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com