
题目列表(包括答案和解析)
23.(10分)肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味
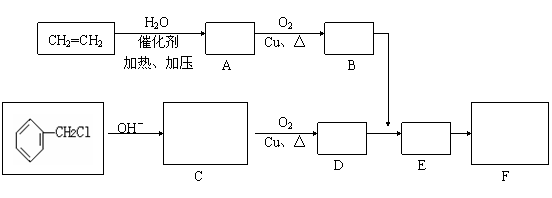 油,工业上主要是按如下路线合成的:
油,工业上主要是按如下路线合成的:
已知:有机物分子中,凡与官能团直接相连的碳原子称为α-碳原子,与α-碳原子连接的氢原子称为α-氢原子。在一定条件下含有α-氢原子的醛(或酮)能与另一分子
 醛(或酮)发生反应,其实质是一个α-氢原子加成在另一个醛或酮的氧原子上,其余
醛(或酮)发生反应,其实质是一个α-氢原子加成在另一个醛或酮的氧原子上,其余
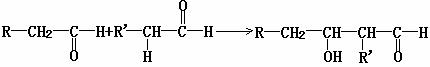 部分加成在羰基(-C-)碳原子上形成羟醛。例如:
部分加成在羰基(-C-)碳原子上形成羟醛。例如:
同时,羟醛不稳定,受热可脱水生成烯醛。
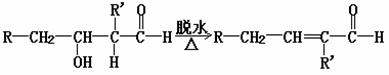

 试回答:
试回答:
(1) 在 条件下可制得 ,在 分子
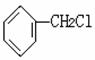 结构中,位于同一平面上的原子最多有 个。
结构中,位于同一平面上的原子最多有 个。
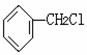
(2)在实验室里鉴定 分子中氯元素时,是将其中的氯元素转化成AgCl
白色沉淀来进行的,其正确的操作步骤是 (请选用序号按一定顺序排列)
A.滴加AgNO3溶液 B.加NaOH溶液 C.加热 D.用HNO3酸化
(3)肉桂醛F的结构简式为: 。
(4)写出下列转化的化学方程式:
A→B
D+B→E
22.(8分)分子式为C3H6O3的物质有多种同分异构体,请写出符合下列要求的各种同分异
构体的结构简式。
说明:①不考虑同一碳原子上连两个羟基;②乙炔、苯等分子中同类原子化学环境相同,
丙、烷、丁烷等分子中同类原子化学环境有两种。
(1)甲分子中没有甲基,且1mol甲与足量金属Na反应生成1molH2。若甲还能与NaHCO3
溶液反应,则甲的结构简式为 ;若甲还能发生银镜反应,
则甲的结构简式为 。
(2)乙分子中所有同类原子的化学环境相同,且不与金属Na反应,则乙结构简式为
。
(3)丙分子中碳与氧分别有两种化学环境,氢的化学环境相同,且丙与金属Na不反应,
则丙结构简式为 。
21.(12分)在100℃时,将0.100mol的N2O4气体充入1 L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下数据:
|
t/s c(mol·L-1) |
0 |
20 |
40 |
60 |
80 |
100 |
|
c(N2O4)/mol·L-1 |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
|
c(NO2)/mol·L-1 |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
⑴该反应的化学方程式为________________ ______,达到平衡时N2O4的转化率为_____ _,表中c3、a、b大小关系为: 。
⑵20 s时N2O4的浓度c1=____________mol·l-1,在0s-20s内N2O4的平均反应速率为___________mol·(L·s)-1
⑶若在相同情况下最初向该容器充入的是NO2气体,要达到上述同样的平衡状态,NO2的起始浓度是_________mol·L-1。
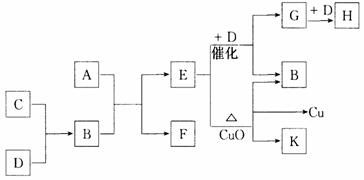
20.(10分)A为甲、乙两种短周期元素组成的化合物,其摩尔质量为100g·mol – 1,甲元素的原子最外层电子数与K层电子数相等,E的水溶液显碱性,K为乙元素的单质。C为单质,其原子在周期表中半径最小。D为气体,对空气的相对密度为1.103。在适当的条件下,它们相互之间有如下图所示的转化关系:
试填写下列空白:
(1)甲元素的单质在空气中燃烧出得到A外,还可得到__________________,物质F的电子式为 。
(2)反应“E + D→G + B”在 工业中的重要反应之一,“E + CuO”的化学方程式为:______________________________。
(3)C和D还能在一定条件下还能形成另一种化合物I,I与一种弱酸的酸性氧化物反应生成强酸,该反应的离子方程式为 。
19.(8分)A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。D、A按原子个数比3∶2形成离子化合物丙。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是____________,乙物质的电子式是____________·
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是____________(用元素符号填写)。
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是___________。
18.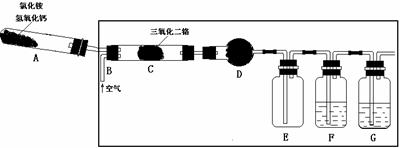 (12分)硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取。某校 化学兴趣小组的同学以氯化铵和氢氧化钙为主要原料并设计了下列装置来制硝酸(三氧化二铬为催化剂,加热及夹持装置未画出):
(12分)硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取。某校 化学兴趣小组的同学以氯化铵和氢氧化钙为主要原料并设计了下列装置来制硝酸(三氧化二铬为催化剂,加热及夹持装置未画出):
回答下列问题:
⑴ 实验时,A、C两装置均需加热,应先加热 装置,原因是 ;
⑵ D装置中应填充的物质是 ,该物质的主要作用是 ;
⑶ E装置的作用是 ,F、G装置中的物质分别是 , ;
⑷ 若保留上图中黑色粗线框内的装置但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中划出装置图并注明所用药品的名称)。
17.(7分)(1)下面所列的是中学化学实验室中几种常见的仪器:
容量瓶 、酸式滴定管、碱式滴定管、温度计、量筒 、托盘天平、 普通漏斗 、烧杯
①若要进行中和滴定实验,还缺少的玻璃仪器是 ;
②若要用碳酸钠固体配制一定物质的量浓度的碳酸钠溶液,还缺少的玻璃仪器是 ;
③使用酸式滴定管的第一步操作是 ;
④中和热测定时,一次完整实验,温度计应使用 次。
(2)下列实验最后结果与理论值相比,偏小的是
A.配制一定物质的量浓度溶液时,药品与砝码放反了,游码读数为0.3g,所得溶液的浓度
B.酸碱中和滴定时,滴定终点仰视标准液滴定管读数,所得待测液的浓度
C.中和热测定实验时,用铜质搅拌棒代替环形玻璃搅拌棒,所得的中和热的数值
D.测定硫酸铜晶体结晶水含量时坩埚内有高温不分解的固体物质,所得到的结晶水的含量
16.向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为3: 1其原因可能是
A.两溶液的体积相同,酸是多元强酸
B.若酸为一元强酸,酸溶液的体积是碱溶液体积的3倍
C.两溶液的体积相同,酸是弱酸
D.酸是强酸,且酸溶液的浓度比NaOH溶液浓度大
第Ⅱ卷(非选择题 共86分)
15.在一密闭容器中有如下反应:aX(g)+bY(g) 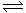 nW(g);ΔH=Q
nW(g);ΔH=Q
某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
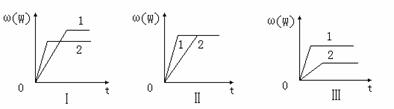
其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
B.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
C.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
D.图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q<0
14.硝苯地平缓释片(Nifedipine Sustained Release Tablets)用于治疗各种类型的高血压及心绞痛,其结构式如右图所示:
下列关于硝苯地平缓释片的说法正确的是
A.硝苯地平缓释片的分子式为C17H17N2O6
B.1mol硝苯地平缓释片在水溶液中最多能消耗4molNaOH
C.1mol硝苯地平缓释片在一定条件下能和5molH2发生加成反应
D.硝苯地平缓释片中N的化合价为-3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com