
题目列表(包括答案和解析)
20.(12分)某研究性学习小组对Zn跟一定量的浓硫酸反应生成的气体产物进行探究。
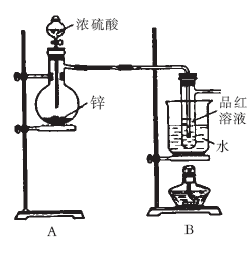 [提出假设]
[提出假设]
小组同学经过分析讨论认为生成气体可能含
H2和SO2。
(1)认为生成气体中含H:的理由是
。
[设计实验方案,验证假设]主要包括两个
环节:
I.验证SO2,实验装置如右图所示;
Ⅱ.检验产物中含有H2,实验内容为将由B部
分导出的气体依次通过装置C、D、E、F、G。
(2)盛放锌粒的仪器名称是 。
(3)B部分装置的目的是验证SO2并探究SO2与
品红作用的可逆性。实验中操作及现象是
。
(4)Ⅱ中装置C、D、E、F、G的信息如下表所示:
|
仪器标号 |
C |
D |
E |
F |
G |
|
仪器 |
洗气瓶 |
洗气瓶 |
硬质玻璃管,加热 |
干燥管 |
干燥管 |
|
仪器中所加物质 |
NaOH溶液 |
浓硫酸 |
CuO粉末 |
试剂X |
无水CaCl2固体 |
①装置C、D的作用依次是 、 。
②E中发生反应的化学方程式是 。
③试剂X是 。
19.(11分)四氢呋喃是一种重要的有机化工及精细化工原料,可由下列流程合成:

回答相关的问题:
(1)写出A的结构简式: 。
(2)下列有关化合物B和化合物D的叙述正确的是 。
a.B能发生取代反应
b.用酸性高锰酸钾溶液能检验D中的碳碳双键
c.B和D均易溶于水
d.一定条件下,D能和H。O发生加成反应
(3)D→E的反应类型是 。D经聚合反应生成的高聚物是 (写结构简式)。
(4)G的一氯代物有4种,写出F→G的化学方程式: 。
(5)四氢呋喃的同分异构体有多种,写出一种能使新制氢氧化铜悬浊液反应的四氢呋喃的同分异构体 。
18.(10分)X、Y、Z、M是周期表前四周期中的四种常见元素,原子序数依次增大,其相关信息如下表:
|
元素 |
相关信息
|
|
X |
原子最外层电子数是内层电子数的2倍 |
|
Y |
基态原子最外层电子排布为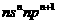 |
|
Z |
与Y同周期,第一电离能小于Y |
|
M |
与X形成的合金为目前用量最多的金属材料 |
(1)Z位于周期表第 周期第 族。Y、Z的氢化物稳定性较强的是 (写化学式)。
(2)X与氢可形成一种原子个数比为1:1的化合物,相对分子质量为78,该分子中存在
个 键。H-X、H-Y、H-Z三种共价键中,键长最长的是
。
键。H-X、H-Y、H-Z三种共价键中,键长最长的是
。
(3)M元素基态原子的电子排布式是 。
(4)已知下列数据:
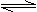 M(s)+
M(s)+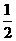 Z2(g) MZ(s) △H=-272.kJ·mol-1
Z2(g) MZ(s) △H=-272.kJ·mol-1
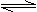 2M(s)+
2M(s)+ Z2(g) M2Z3(s) △H=-824.2.kJ·mol-1
Z2(g) M2Z3(s) △H=-824.2.kJ·mol-1
MZ转化为M2Z3的热化学方程式是
17.(9分)F是有机合成中的重要试剂,工业上可用以下流程合成:
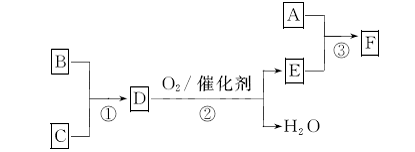
已知A、B、C为单质,D的水溶液呈碱性。A-F常温下均为气体,除A呈黄绿色外,其余均无色,工业上通过电解饱和食盐水得到A。
(1)常温下向D的水溶液中逐滴加人稀盐酸至pH一7,用一个等式表示所得溶液中所有离子浓度之间的关系: 。
(2)取0.3 mol B和0.1 mol C放入容积为1 L的密闭容器中,在一定条件下反应,达到平衡后得到0.12 mol D,此时缩小容器容积为0.5 L, (D)将
(填“增大”、“减小”或“不变”,下同),反应的平衡常数
。
(D)将
(填“增大”、“减小”或“不变”,下同),反应的平衡常数
。
(3)工业上电解饱和食盐水制取A时,A在 极生成。实验室制取A的化学方程式为: 。
(4)已知反应③中参加反应的A、E物质的量之比为1:2,则F的化学式为: 。
16.(9分)用硫铁矿烧渣(主要成分为铁的氧化物和少量SiO2)为原料制取无机高分子絮凝剂聚合硫酸铁(PFS)的实验流程如下:
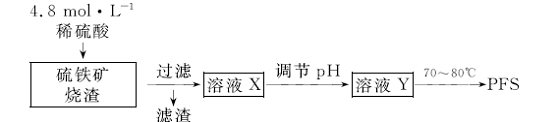
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 。
(2)滤渣的主要化学成分是
(3)向溶液X中加入过量的铁粉后过滤,滤液经浓缩、结晶可制得绿矾,加入铁粉后发生的主要反应的离子方程式为 。
(4)溶液Y的pH影响产品中铁的质量分数,用pH试纸测定溶液pH的操作方法是 。若溶液Y的pH偏小,所得PF、S中铁的质量分数将偏 (填“高”或“低”)。
15.(7分)在浓CaCl2溶液中通入氨气和CO2,再经过滤可以制得纳米碳酸钙。
(1)除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是
。
(2)若不通入氨气能否生成CaCO3? 。
(3)若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。

(4)根据上述反应原理,向饱和食盐水中通入氨气和CO2能得到NaHCO3,若食盐水中含有KCl杂质,则检验得到的NaHCO3中是否混有钾盐的方法是 。
14.一定条件下,在一容积固定的密闭容器中充入2molNO和1molO2,发生反应:
 2NO+O2===2NO2、2NO2 N2O4。下列推测中,正确的是 ( )
2NO+O2===2NO2、2NO2 N2O4。下列推测中,正确的是 ( )
A.平衡时体系中含NO、O2、NO2、N2O4
B.平衡后容器中压强为开始时的2/3
C.达到平衡后,压缩容器容积,混合气体颜色变浅
D.达到平衡后,再充入少量O2混合气体颜色不变
第Ⅱ卷(非选择题,共58分)
本卷共6小题,共58分。
13.右图是空气氧化Fe2+为Fe3+过程中的实验结果,
下列有关说法正确的是 ( )
A.80℃下氧化效果较50℃好,说明该氧化反应是
吸热反应
B.最佳氧化条件为80℃、pH=1.5下氧化4小时左右
C.pH=1.5时氧化效果一定比pH=2.5时好
D.氧化的离子方程式为:Fe2++O2+4H+===Fe3++2H2O
12.25℃时,浓度均为0.1mol·L-1的NaHCO3和Na2CO3溶液中,都存在的离子浓度关系是
( )
A.c(H+)·c(OH-)=10-14
B.c(Na+)+c(H+)=c(CO2-3)+c(OH-)+c(HCO-3)
 C.c(Na+)=c(CO2-3)+c(HCO-3)+c(H2CO3)
C.c(Na+)=c(CO2-3)+c(HCO-3)+c(H2CO3)
D.c(Na+)>c(HCO-3)+c(CO2-3)>c(OH-)>c(H+)
11.下列反应的离子方程式书写正确的是 ( )
A.将氯气溶于水制备次氯酸:Cl2+H2O===H++Cl-+ClO-
B.Fe3O4与过量的稀HNO3反应:Fe3O4+8H+===Fe2++2Fe3++4H2O
C.Na2CO3稀溶液中通入少量CO2:CO2-3+CO2+H2O===2HCO-3
D.小苏打与氢氧化钠溶液混合:HCO-3+OH-===CO2↑+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com