
题目列表(包括答案和解析)
21.某同学对Cu与HNO3的反应进行如下探究。请回答有关问题。
⑴用右图所示装置制取NO,验证U型管中生成的气体是NO的实验
方法是 。
⑵将0.64g Cu全部溶于一定量的浓HNO3中,测得生成气体0.009mol(含NO、NO2和N2O4),共消耗HNO3 0.032 mol。将生成的气体与空气混合,再通入NaOH溶液中,氮氧化物被完全吸收,产物只有NaNO3和H2O。
①计算空气中参加反应的O2在标准状况下的体积为 mL。
②计算0.009 mol 混合气体中N2O4的物质的量 。
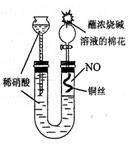
20.火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为______________。
(2)脱碳。将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)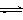 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①取五份等体体积CO2和H2的的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线,则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。

②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如右下图所示。下列说法正确的是 (填字母代号)。
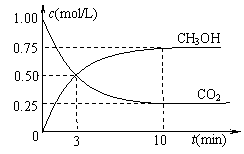 A.第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时c(CH3OH)=1.5
mol/L
A.第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时c(CH3OH)=1.5
mol/L
B.达到平衡时,氢气的转化率为0.75
C.0~10分钟内,氢气的平均反应速率为0.075 mol/(L·min)
D.该温度下,反应的平衡常数的值为3/16
E.升高温度将使n(CH3OH)/n(CO2)增大
 ③直接甲醇燃料电池结构如右下图所示。其工作时负极电极反应式可表示为 。
③直接甲醇燃料电池结构如右下图所示。其工作时负极电极反应式可表示为 。
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为
。
19.(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
 ①在步骤a中,还需要通入氧气和水,其目的是 。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
①在步骤a中,还需要通入氧气和水,其目的是 。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在 范围。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe3+
Cu2+ |
1.9
4.7 |
3.2
6.7 |
不用加水的方法调节溶液pH的原因是 。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明) 。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是 。
 (3)下图是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O
]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是 (填字母)。
a. A点时的溶液为不饱和溶液
b. B点时两种晶体可以共存
c.按上述流程最终得到的晶体是
(3)下图是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O
]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是 (填字母)。
a. A点时的溶液为不饱和溶液
b. B点时两种晶体可以共存
c.按上述流程最终得到的晶体是
Cu(NO3)2·3H2O d.若将C点时的溶液降温至 30℃以下,
可以析出Cu(NO3)2·6H2O晶体
(4)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3 NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是 ;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是 。
NH4++NH2-,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18,则液态N2O4电离的方程式是 ;Cu与液态N2O4反应制得无水硝酸铜的化学方程式是 。
18.铜和稀硝酸在常温常压下反应,开始时反应非常慢,但是随着反应的进行,反应速率不断地加大。某校合作学习小组的同学拟探究影响其速率的主要因素。
(1)甲同学认为是生成的Cu2+对该反应起催化作用,欲验证其假设是否正确,其实验方法是:_ _ 。
(2)乙同学依据铜和硝酸是放热反应,拟研究温度升高是否为该反应速度率不断加大的主要原因,实验结果如下:

由此可得到的结论是_ _ 。
(3)丙同学查阅文献,得知稀硝酸与铜反应,还原产物起始也是NO2,NO2对该反应起催化作用。通过下列装置验证。实验发现左侧3min后开始大量产生气泡,右侧40min内无明显变化。
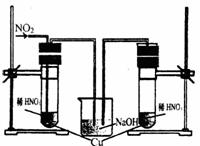
①氢氧化钠溶液的作用是_ _ 。
②该学生设计在左侧加的是2mol·L-1 HNO3溶液,右侧加的是1.2 mol·L-1 硝酸。左侧浓度稍偏小,这样设计主要是考虑到 _ 。
(4)丁同学与丙同学交流后,他将实验改进为:在试管中加入3mL2mol·L-1 HNO3并放入铜片,然后加入几粒NaNO2晶体,发现只需1秒钟,铜片表面就开始产生气泡。由丁的实验可得出的结论是:_ _ 。
17.已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应)。某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
电解时,粗铜应与电源的 极相连,阴极上的电极反应式为 。电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,该步反应的离子方程式为 。残渣含有极少量的黄金。为了回收金,他们查阅了有关资料(见下表):
|
序号 |
反应 |
化学平衡常数 |
|
1 |
Au + 6HNO3(浓) Au(NO3)3 + 3NO2↑+ 3H2O Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
|
2 |
Au3+
+ 4Cl- = AuCl4- |
>>1 |
从资料中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你从化学平衡移动的角度简要解释金能够溶于王水的原因 。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程:

则100mL滤液中Cu2+ 的浓度为 mol·L-1 ,Fe2+的浓度为 _________________mol·L-1。
16.科学家从化肥厂生产的(NH4)2SO4中检出组成为N4H4(SO4)2 的物质,经测定,该物质易溶于水,在水中以SO42_和N4H44+两种离子形式存在,植物的根系极易吸收花菜N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
请回答下列问题:
(1)N4和N2的关系正确的是______________(填序号)
A. 同种单质 B. 同位素 C. 同分异构体 D. 同素异形体
(2)N4H4(SO4)2___________(填“能”或“不能”)和草木灰混合施用。
(3)已知白磷、NH4+ 、N4H44+ 的空间构型均为四面体,NH4+的结构式为
( 表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
请画出N4H44+的结构式____________________________________;

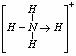
(4)已知液氨中存在着平衡 。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_________________;
。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_________________;
(5)含有一定量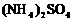 和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
加酸时: ;
;
加碱时: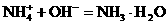
由于 和
和 的大量存在,加少量酸或碱时,溶液中
的大量存在,加少量酸或碱时,溶液中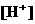 与
与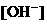 基本保持不变;
基本保持不变;
含有一定量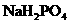 和
和 的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
加酸时_______________________________;
加碱时_________________________________
15.某研究性学习小组用下列仪器和药品验证由Cu、Zn组成的合金和适量浓硝酸反应所产生的气体中含有NO。(N2和O2的用量可自由控制,气体液化温度:NO2 21℃;NO -152 ℃)
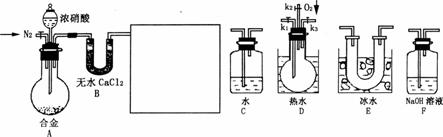
(1)在上右图中选择恰当的仪器将上左图的实验装置补充完整,按所选仪器的连接顺序(左→右),各仪器的编号为 。
(2)反应前要先通一会儿N2,目的是 。
(3)确认气体中含NO的现象是 。
(4)当O2过量时,装置F中发生反应的化学方程式是 。
(5)实验结束后,关闭K1、K2、K3,将D中的烧瓶从烧杯里拿出,观察现象,并给出合理的解释: 。
(6)若含a mol溶质的浓硝酸完全反应,还原产物只有NO和NO2,被还原的硝酸的物质的量n的取值范围为 。
14.将2.4gFe、Mg合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体VL(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6g。则收集到的气体体积V的值不可能为
A.6.72 B.1.12 C.1.00 D.0.986
非选择题
13.标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为cmol/L,则下列关系中不正确的是
A.ρ = (17V + 22400) / (22.4 + 22.4V) B.ω = 17c / (1000ρ)
C.ω = 17V / (17V + 22400) D.c = 1000Vρ / (17V + 22400)
12.下列画有横线的物质,在反应中不能被完全消耗的是
A.将含有少量H2O(g)的H2通入盛有足量Na2O2容器中并不断用电火花点燃
B.将1molCu置于2molH2SO4的浓硫酸中加热
C.在一定条件下3体积H2和3体积Cl2在光照下反应
D.在强光持续照射下,向过量的Ca(ClO)2溶液中通入少量的CO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com