
题目列表(包括答案和解析)
8.还原2.4×10-3 mol XO(OH)3+到X元素的低价态时,消耗0.2mol·L-1的Na2SO3溶液30 mL,则X元素反应后的价态是 ( )
A.+1 B.一1 C.0 D.一2
7.有三种说法:①NH4NO3中氮元素显+5价;②4FeS2+11O2→2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;③氧化还原反应中还原剂得电子数与氧化剂失电子数一定相等。这三种说法中错误的是 ( )
A.只有① B.只有②③ C.只有①③ D.①②③
6.下列离子方程式中正确的是 ( )
A.将SO2气体通入NaCIO溶液中:SO2+2ClO-+H2O=SO32-+2HCIO
B.向FeBr2溶液中通入过量Cl2:2Fe2++4Br-+2Cl2=2Fe3++2Br2+4Cl-
C.向硫酸氢钾溶液中加入Ba(OH)2溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
D.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
5.下列溶液中,各组离子一定能大量共存的是 ( )
A.在强酸性溶液中:K+、NH4+、SO42-、C1O-
B.能使石蕊试液呈蓝色的溶液中:Na+、I-、CI-、NO3-
C.在pH=l的溶液中:NH4+、Mg2+、SO32-、NO3-
D.含有大量Al3+的溶液中:NH4+、Na+、Cl-、HCO3-
4.在三个密闭容器中分别充入CO、CH4、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是 ( )
A.p(CO)>p(CH4)>p(O2) B.p(O2)>p(CO)>p(CH4)
C.p(CH4)>p(O2)>p(CO) D.p(CH4)>p(CO)>p(O2)
3.右图是某学校实验室从化学试剂商店买同的硫酸试剂标
签上的部分内容。据此下列说法正确的是 ( )
A.该硫酸的物质的量浓度为 1.84mol/L
B.1mol Zn与足量的该硫酸反应产生2gH2
C.配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL
D.该硫酸与等质量的水混合所得溶液的物质的量浓度等于9.2mol/L
2.氯化铁溶液与氢氧化铁胶体具有的共同性质是 ( )
A.分散质颗粒直径都在l-100nm之间
B.能透过半透膜
C.加热蒸干、灼烧后都有氧化铁生成
|
1.关于物质的分类正确的是 ( )
A.SO2、CO2、CO、NO2都是酸性氧化物
B.Na2O、Na2O2、Fe2O3、CuO都是碱性氧化物
C.HCI、HClO、HClO3、HClO4都是强酸
D.NaOH、KOH、Ba(OH)2都是强碱
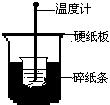
21.50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值将_______(填“偏大”、“偏小”或“无影响”)。
(3)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量________(填“相等”或“不相等”),但中和热应_________(填“相等”或“不相等”),简述理由_________________________________。
20.《硫酸铜晶体里结晶水含量的测定》是中学化学中的重要实验,请回答下列该实验的相关问题。
(1)实验中能直接加热的仪器名称为____________;进行的称量操作至少为________次。
 (2)下列操作会引起测定结果偏高的是__________________
(2)下列操作会引起测定结果偏高的是__________________
A.加热时温度过高CuSO4发生分解 B.加热后在空气中冷却再称量
C.加热过程中有晶体溅出 D.晶体部分风化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com