
题目列表(包括答案和解析)
20. (10分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
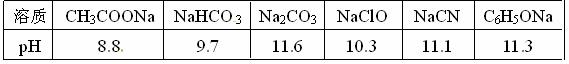 复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
A.CO2+H2O
+2NaClO=Na2CO3+2HClO
B.CO2+H2O
+NaClO=NaHCO3+HClO
C.CO2
+H2O +C6H5ONa
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
A.CO2+H2O
+2NaClO=Na2CO3+2HClO
B.CO2+H2O
+NaClO=NaHCO3+HClO
C.CO2
+H2O +C6H5ONa NaHCO3+C6H5OH
D.CO2
+H2O +2C6H5ONa
NaHCO3+C6H5OH
D.CO2
+H2O +2C6H5ONa Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH
Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH NaHCO3+C6H5ONa
F.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,常温下浓度均为0.05 mol/L的下列5种物质的溶液中,pH最小的是_____(填编号),其pH值为_______(填数值);pH最大的是____(填编号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
请根据上述反应,总结出复分解反应发生的另一规律:
;
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是
,反应的离子方程式为
。
NaHCO3+C6H5ONa
F.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,常温下浓度均为0.05 mol/L的下列5种物质的溶液中,pH最小的是_____(填编号),其pH值为_______(填数值);pH最大的是____(填编号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
请根据上述反应,总结出复分解反应发生的另一规律:
;
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是
,反应的离子方程式为
。
19. (12分) (1)配平氧化还原反应方程式: C2O42-+ MnO4-+ H+= CO2+ Mn2++ H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。 ①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为 mol。 ②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由 变为 。该溶液中还原剂的总物质的量为 mol。 ③原试样中H2C2O4·2H2O的质量分数为 。KHC2O4的质量分数为 。
18.  (10分)
(10分)
|
 (1)写出M溶于稀H2SO4和H2O2混合液的离子方程式:
。
(2)某同学取X的溶液,用稀硫酸酸化并搅拌后,加入淀粉KI溶液,溶液变为蓝色。写出与上述变化过程相关的离子方程式:
、
。
(3)写出Cl2将Z氧化为K2EO4的化学方程式:
。
(4)由E制备出的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为:
(1)写出M溶于稀H2SO4和H2O2混合液的离子方程式:
。
(2)某同学取X的溶液,用稀硫酸酸化并搅拌后,加入淀粉KI溶液,溶液变为蓝色。写出与上述变化过程相关的离子方程式:
、
。
(3)写出Cl2将Z氧化为K2EO4的化学方程式:
。
(4)由E制备出的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。17.
(10分)某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此实验小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。
 已知:常温下,CO能使一些化合物中的金属离子被还原。
例如:PdCl2+CO+H2O=Pd↓+CO2+2HCl
反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
请回答下列问题:
(1)通常实验室制取CO2气体的离子方程式是
,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是
(填写“Ⅰ”、“Ⅱ”或“Ⅲ”)。若要制取干燥、纯净的CO2气体,装置B中应盛放的试剂是
溶液,装置C中应盛放的试剂是
。
(2)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是
。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是
。
已知:常温下,CO能使一些化合物中的金属离子被还原。
例如:PdCl2+CO+H2O=Pd↓+CO2+2HCl
反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
请回答下列问题:
(1)通常实验室制取CO2气体的离子方程式是
,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是
(填写“Ⅰ”、“Ⅱ”或“Ⅲ”)。若要制取干燥、纯净的CO2气体,装置B中应盛放的试剂是
溶液,装置C中应盛放的试剂是
。
(2)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是
。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是
。
16. (13分)某无色溶液,由Na+、Ba2+、Al3+、AlO2-、Fe3+、CO32-、SO42-中的若干种组成。取适量该溶液进行如下实验: ①加入过量盐酸,有气体生成; ②在上面所得的溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲; ③在②所得溶液中再加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。 (1)则原溶液中一定不能大量存在的离子是 ,可能存在的离子是 。 (2)实验①中发生反应的离子方程式为 , 。 (3)实验②中气体成分是 ,沉淀甲的成分是 。 (4)实验③中气体成分是 ,沉淀乙的成分是 。
15.
amolFeS与bmolFe3O4投入到VL cmol/L的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为
A.(a+3b)mol B.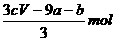 C.
C.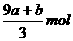 D.(cV-3a-9b)mol
D.(cV-3a-9b)mol
第Ⅱ卷(共计55分)
14.
铅的冶炼大致过程如下:
①富集:将方铅矿(PbS)进行浮选;
②焙烧:2PbS+3O2  2PbO+2SO2;
③制粗铅:PbO+C
2PbO+2SO2;
③制粗铅:PbO+C Pb+CO;PbO+CO
Pb+CO;PbO+CO Pb+CO2。
下列说法正确的是
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
C.整个冶炼过程中,制取1molPb共转移2mol电子
D.将1molPbS完全冶炼成Pb理论上至少需要6g碳
Pb+CO2。
下列说法正确的是
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
C.整个冶炼过程中,制取1molPb共转移2mol电子
D.将1molPbS完全冶炼成Pb理论上至少需要6g碳
13.
下列曲线图与对应选项不正确的是
 A.向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液中逐滴加入0.1 mol/L稀H2SO4溶液
B.向含有0.1
mol/L AlCl3和0.3mol/L NH4Cl的1L混合液中逐滴加入0.1mol/L NaOH溶液
C.向烧碱溶液中逐滴加入明矾溶液
D.向Ba(OH)2溶液中逐渐通入二氧化碳气体
A.向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液中逐滴加入0.1 mol/L稀H2SO4溶液
B.向含有0.1
mol/L AlCl3和0.3mol/L NH4Cl的1L混合液中逐滴加入0.1mol/L NaOH溶液
C.向烧碱溶液中逐滴加入明矾溶液
D.向Ba(OH)2溶液中逐渐通入二氧化碳气体
12. 在烧杯中加水和苯(密度:0.88 g/cm3)各50 mL。将一小粒金属钠(密度:0.97 g/cm3)投入烧杯中。观察到的现象可能是 A.钠在水层中反应并四处游动 B.钠停留在苯层中不发生反应 C.钠在苯的液面上反应并四处游动 D.钠在苯与水的界面处反应并可能作上、下跳动
11. 下列各组离子在指定溶液中能大量共存的是 ①无色溶液中:K+、Cu2+、Na+、SO42- ②pH=11的溶液中:CO32-、Na+、[Al(OH)4]-、NO3- ③加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、NH4+ ④由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、I- ⑤能使pH试纸变为蓝色的溶液:Na+、C1-、S2-、ClO- ⑥无色溶液中:K+、Al3+、NO3-、HCO3- A.①②⑤ B.③⑤⑥ C.②④ D.②④⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com