
题目列表(包括答案和解析)
18.钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。
(1)V2O5是接触法制硫酸的催化剂。
①一定条件下,SO2与空气反映t min后,SO2和SO3物质的量浓度分别为a mol/L和b mol/L, 则SO2起始物质的量浓度为 mol/L ;生成SO3的化学反应速率为 mol/(L·min)。
②工业制硫酸,尾气SO2用_______吸收。
(2)全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示。
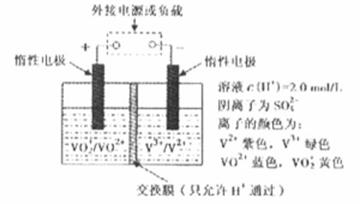
①当左槽溶液逐渐由黄变蓝,其电极反应式为 。
②充电过程中,右槽溶液颜色逐渐由 色变为 色。
③放电过程中氢离子的作用是 和 ;充电时若转移的电子数为3.01 1023个,左槽溶液中n(H+)的变化量为
。
1023个,左槽溶液中n(H+)的变化量为
。
17.如图(a)为持续电解饱和CaCl2水溶液的装置(以铂为电极,A为电流表),电解1小时后
Cl-放电完毕,图(b)从1小时起将CO2连续通入电解液中,请在图(b)中完成实验(a)中
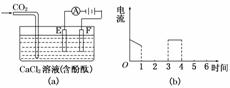 电流对时间的变化关系图,并回答有关问题:
电流对时间的变化关系图,并回答有关问题:
(1)完成实验(a)中电流对时间的变化关系图.
(2)电解时F极发生________反应,电极反应式为
_________________________________ ____;
通CO2前电解的总化学方程式为
______ ___。
(3)通CO2前电解池中产生的现象:
①______________________________________________________________________;
②______________________________________________________________________;
③______________________________________________________________________.
16.Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和石墨,电解液是LiAlCl4
-SOCl2。电池的总反应可表示为:4Li + 2SOCl2 === 4LiCl + S + SO2.
请回答下列问题:
(1)电池的负极材料为_____ _____,发生的电极反应为____________ ______;
(2)电池正极发生的电极反应为_________________________________________ ___;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是______________________________ ______,
反应的化学方程式为________________________________________ ________;
(4)组装该电池必须在无水、无氧的条件下进行,原因是
________________________________________________________________________
_______________________________________________________________________。
15.工业上处理含Cr2O的酸性工业废水常用以下方法:①往工业废水里加入适量的NaCl,
搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③
过滤回收沉淀,废水达到排放标准。试回答:
(1)电解时的电极反应:阳极_______________________,阴极_______________________。
(2)Cr2O转变成Cr3+的离子反应方程式:
______________________________________________________ ____。
(3)电解过程Cr(OH)3、Fe(OH)3沉淀是怎么产生的?
_____________________________________________ ________ ______。
(4)能否用Cu电极来代替Fe电极?________(填“能”或“不能”),简述理由
_______________________________________________________________ __ __。
14.某化学小组对生石灰与水反应是显著放热反应进行了实验探究,在除了用手触摸试管壁管感觉发热外,还设计了下列几个可行性方案。
甲方案:将温度计与盛放有生石灰的小试管用橡皮筋捆绑在一起,放入有水的小烧杯中,用胶头滴管向小试管中缓缓滴入水,看到的现象是
____________________________________________________ _________________,
__________________________________________ ________ __,说明反应放热。
(下列装置中支撑及捆绑等仪器已略去)
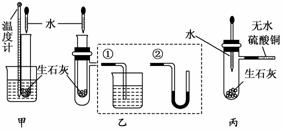
乙方案:将盛放有生石灰的小试管插入带支管的试管中,支管接①或②,用胶头滴管向小试管中缓缓滴入水,看到的现象是(接①)________ ______,
(接②)__________________ ________________,说明反应放热。
丙方案:用胶头滴管向盛放有生石灰且带支管的试管中滴加水,支管接的导管中盛适量无水硫酸铜粉末,看到的现象是______________________________,说明反应放热,其原因是__________________________________________________ _
____________________________________________________ ________________。
13.美国“阿特兰蒂斯号”航天飞机于2009年5月11日升空修复哈勃望远镜.
(1)“阿特兰蒂斯号”使用的燃料是液氢和液氧,下面是298K时,氢气(H2)、碳(C)、辛烷(C8H18)、甲烷(CH4)燃烧的热化学方程式:
H2(g)+1/2O2(g)===H2O(l) ΔH =-285.8 kJ·mol-1
C(g)+O2(g)===CO2(g) ΔH =-393.5 kJ·mol-1
C8H18(l)+25/2O2(g)===8CO2(g)+9H2O(l)
ΔH =-5518 kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH =-890.3 kJ·mol-1
相同质量的H2、C、C8H18、CH4完全燃烧时,放出热量最多的是__________,等质量的氢气和碳燃烧时产生热量的比是______ ___(保留1位小数)。
(2)已知:H2(g)===H2(l) ΔH=-0.92 kJ·mol-1
O2(g)===O2(l) ΔH=-6.84 kJ·mol-1
H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
写出液氢和液氧生成气态水的热化学方程式______________ ________。
(3)如果此次“阿特兰蒂斯号”所携带的燃料为45吨,液氢、液氧恰好完全反应生成气态水,总共释放能量____________________kJ(保留3位有效数字)。
12.右图是一种航天器能量储存系统原理示意图。下列说法正确的是
 A.该系统中只存在3种形式的能量转化
A.该系统中只存在3种形式的能量转化
B.装置Y中负极的电极反应式为:

C.装置X能实现燃料电池的燃料和氧化剂再生
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化
11.将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录
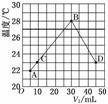 溶液温度,实验结果如图所示(实验中始终保持V1+V2=50
溶液温度,实验结果如图所示(实验中始终保持V1+V2=50
mL)。下列叙述正确的是
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.5 mol·L-1
D.该实验表明有水生成的反应都是放热反应
10.按下图所示装置做实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示
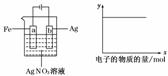 ①c (Ag+) ②c(NO) ③a棒的质量
①c (Ag+) ②c(NO) ③a棒的质量
④b棒的质量 ⑤溶液的pH
A.①③ B.③④
C.①②④ D.①②⑤
9.如图所示,下列叙述正确的是
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触处变红
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com