
题目列表(包括答案和解析)
2.下列各物质中,前者是纯净物,后者是混合物的是( )
A.水煤气、铝热剂 B.硫酸铜晶体、漂白粉
C.盐酸、磷酸钙 D.玻璃、含Fe为70%的氧化铁
1.下列说法正确的是( )
A.可用丁达尔现象区分溶液与胶体 B.生石灰与水混合的过程只发生物理变化
C.O3是由3个氧原子构成的化合物 D.CuSO4·5H2O是一种混合物
17.解析:电解CaCl2时,阳极Cl-放电产生Cl2,阴极H+放电产生H2,总电极反应为CaCl2+2H2O===Ca(OH)2+Cl2↑+H2↑;溶液最后变为Ca(OH)2溶液,通入CO2,会变浑浊.而溶质由CaCl2变为Ca(OH)2(溶解度很小)再变为CaCO3过程中,导电性不断减弱,通入过量CO2时,CaCO3溶解变为Ca(HCO3)2,溶液的导电性增强.
答案:(1)
(2)氧化 2Cl--2e-===Cl2↑
CaCl2+2H2O===Ca(OH)2+Cl2↑+H2↑
(3)①F极有气泡产生且能闻到刺激性气味
②E极附近溶液呈红色且有气泡冒出
③连续通入CO2,溶液中先出现白色沉淀,而后沉淀又逐渐消失
18.答案(14分)
(1)①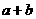 ;
;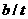
②氨水
(2)①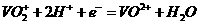
②绿 紫
③参与正极反应; 通过交换膜定向移动使电流通过溶液;0.5mol
[解析]本题考查以钒为材料的化学原理题,涉及化学反应速率和电化学知识.
(1)由S守恒可得,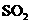 的起始浓度为(a+b)mol/L.
的起始浓度为(a+b)mol/L.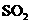 的速率为单位时间内
的速率为单位时间内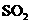 浓度的变化,即b/tmol/(L﹒min).
浓度的变化,即b/tmol/(L﹒min).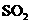 可以用碱性的氨水吸收.
可以用碱性的氨水吸收.
(2)①左槽中,黄变蓝即为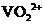 生成
生成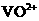 ,V的化合价从+5降低为+4,得一个电子,0 原子减少,从图中知,其中
,V的化合价从+5降低为+4,得一个电子,0 原子减少,从图中知,其中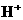 发生了移动,参与反应,由此写成电极反应式.②作为原电池,左槽得电子,而右槽失电子.充电作为电解池处理,有槽中则为得电子,对应化合价降低,即为
发生了移动,参与反应,由此写成电极反应式.②作为原电池,左槽得电子,而右槽失电子.充电作为电解池处理,有槽中则为得电子,对应化合价降低,即为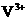 生成
生成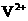 ,颜色由绿生成紫.③由电极反应式知,
,颜色由绿生成紫.③由电极反应式知,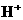 参与了反应.溶液中离子的定向移动可形成电流.n=N/NA=3.01×
参与了反应.溶液中离子的定向移动可形成电流.n=N/NA=3.01× /6.02×
/6.02× =0.5mol.
=0.5mol.
[规律总结]电化学试题的分析一般是从化合价着手,对于原电池,化合价升高的作为负极,化合价降低的作为正极,两极方程式相加即可得总反应.对于电解池,化合价升高作为阳极,降低的作为阴极.两者之间的关系是:正极反应式颠倒即为阳极反应式,负极反应式颠倒即为阴极反应式.
16.解析:分析反应的化合价变化,可得Li为还原剂,SOCl2为氧化剂.
(1)负极材料为Li(还原剂),电极反应为Li-e-=== Li+.
(2)正极反应式可由总反应式减去负极反应式得到:2SOCl2+ 4 e-=== 4Cl-+ S +
SO2.
(3)题中给出有碱液吸收时的产物,则没有碱液吸收时的产物应为SO2和HCl,所以
SOCl2与水反应的现象应该为出现白雾和有刺激性气体生成.
(4)因为构成电池的两个主要成分中Li能和氧气、水反应,SOCl2也与水反应.
答案:(1)锂 Li-e-===Li+
(2)2SOCl2+4e-===4Cl-+S+SO2
(3)出现白雾,有刺激性气体生成 SOCl2+H2O===SO2↑+2HCl↑
(4)锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应
15.解析:(1)阳极Fe为活性电极,反应为Fe-2e-===Fe2+,在阴极是H+放电生成H2,
反应为2H++2e-===H2↑.
(2)阳极生成的Fe2+具有较强的还原性,易被酸性条件下的Cr2O氧化,反应为6Fe2
++Cr2O+14H+===6Fe3++2Cr3++7H2O.
(3)因在阴极H+放电,同时Cr2O氧化Fe2+时都要消耗H+,使溶液的pH上升,
促使Fe3+、Cr3+水解并最终完全转化为Cr(OH)3、Fe(OH)3沉淀.
(4)若用Cu代替Fe电极,则Cu-2e-===Cu2+,但Cu2+无还原性,不能将Cr2O还
原.
答案:(1)Fe-2e-===Fe2+ 2H++2e-===H2↑
(2)6Fe2++Cr2O+14H+===6Fe3++2Cr3++7H2O
(3)在阴极反应及Cr2O与Fe2+反应的过程中,将消耗大量的H+,使溶液pH上升,
促使Fe3+、Cr3+水解并最终转化为Fe(OH)3、Cr(OH)3沉淀
(4)不能 因为阳极产生的Cu2+不能使Cr2O还原到低价
14.解析:实验从反应放热的“热”为出发点进行探究,通过放热使温度上升、使气
体膨胀、水被蒸发等特征现象,合理地设计了实验探究方案.
答案:方案甲:小试管中固体变成乳状,同时有大量水蒸气产生;温度计温度上
升
方案乙:①有气泡产生 ②左边水柱下降,右边水柱上升
方案丙:无水硫酸铜粉末变蓝色 水和生石灰反应放出热量,使水蒸发
5.94×108 kJ.
答案:(1)H2 4.4∶1
(2)H2(l)+1/2O2(l)===H2O(g) ΔH=-237.46 kJ·mol-1
(3)5.94×108
13.解析:(1)问较简单.(2)利用盖斯定律对方程式进行合理变换,可得出H2(l)+
1/2O2(l)===H2O(g)
ΔH=0.92+0.5×6.84+(-285.8)+44=-237.46 kJ·mol-1.(3)45吨燃料中氢气的质
量为2×45/18吨,物质的量为2.5×106 mol,故放出的热量为2.5×106×237.46=
12.[答案]C
[解析]本题主要考查的是电化学知识.A项,在该装置系统中,有四种能量转化的关系,即太阳能、电能、化学能和机械能之间的相互转化;B项,装置Y为氢氧燃料电池,负极电极反应为H2 -2e- + 2OH- = 2H2O;C项,相当于用光能电解水,产生H2和O2,实现燃料(H2)和氧化剂(O2)的再生;D项,在反应过程中,有能力的损耗和热效应的产生,不可能实现化学能和电能的完全转化.综上分析可知,本题选C项.
11.解析:从图中曲线可以看出,温度为22℃时,V1为5 mL,则V2为45 mL,此时已经开始发生反应,所以22℃一定不是室温,A错.从曲线随V1的增多而升高,随反应的进行,溶液温度升高说明反应放热,化学能转化为热能,B正确.当V1=30 mL时温度最高,说明此时两者恰好完全反应,则c(NaOH)==1.5 mol·L-1,C正确.该实验不能证明有水生成的其他反应也是放热的.
答案:BC
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com