
题目列表(包括答案和解析)
1、SO2被认为是造成大气污染的“首犯”,大气中的SO2主要来源于化石燃料(煤、石油)的燃烧。下列与SO2污染有关的是
①酸雨现象 ②伦敦“毒雾事件” ③洛杉矶“光化学烟雾”事件 ④温室效应
A.①③ B.②④ C.①② D.③④
24.(10分)X、Y都是芳香族化合物,均为常见食用香精,广泛用于化妆品、糖果及调味品中。1mol X水解得到1 molY和1mol CH3CH2OH,X、Y的相对分子质量都不超过200,完全燃烧都只生成CO2和H2O。且x分子中碳和氢元素总的质量百分含量约为81.8%。
(1)1个Y分子中应该有 个氧原子。
(2)X的分子式是  。
。
(3)G和X互为同分异构体,且具有相同的官能团,用芳香烃A合成G路线如下:

①写出A的结构简式 。
②E→ F的反应类型是
反应,该反应的化学方程式为
。
F的反应类型是
反应,该反应的化学方程式为
。
③写出所有符合下列条件的F的同分异构体的结构简式: 。
i.分子内除了苯环无其他环境结构,且苯环上有2个对位取代基。
ii.一定条件下,该物质既能与银氨溶液发生银镜反应也能和FeCl3溶液发生显色反应。
23.(10分)某硫酸铁样品含有少量硫酸亚铁杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:

 请根据上面流程,回答以下问题:
请根据上面流程,回答以下问题:
(1)操作I中除了烧杯、玻璃棒外还要用到的玻璃仪器是 ,
(2)操作II用到的仪器是 。
A.碱式滴定管 B.50mL量筒 C.10mL量筒 D.25mL移液管
(3)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 (列出原始算式,不需化简)。
(4)某同学认为可以从操作Ⅱ后获得的250.00mL溶液开始,设计定量实验测定硫酸亚铁的含量,请你分析该同学的实验设计。
a取待测溶液25.00mL置于锥形瓶中;
b取某浓度的高锰酸钾酸性溶液装到酸式滴定管中,并调整好液面记录读数;
c滴定并记录读数;
d根据数据进行计算
①甲同学认为a、b间少了滴入指示剂的环节,请判断有无必要并说明理由。
。
②乙同学认为c、d间少了一个环节,请判断是何环节,并说明理由。
。
22. (10分)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。(已知:2 SO2 (g)+O2(g)
(10分)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。(已知:2 SO2 (g)+O2(g)  2SO3(g) △H=-196.6 KJ·mol- 1)
2SO3(g) △H=-196.6 KJ·mol- 1)


请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)恒容条件下,下列措施中能使n(SO3)/ n(SO2 )比图1所示情况增大的有______。
A.升高温度; B.充入He气
C.再充入1molSO2 (g)和1molO 2 (g) D.使用催化剂
(3)恒温恒容时,1molSO2和2molO 2 充分反应,放出热量的数值比∣ΔH2 ∣ (填“大”“小”或“相等”)
(4)某SO2 (g)和O 2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率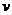 与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则图中t4时引起平衡
与时间t的关系如图2所示,若不改变SO2 (g)和O 2 (g)的量,则图中t4时引起平衡 移动的条件可能是
_;图中表示平衡混合物中SO3的含量最高的一段时间是
。
移动的条件可能是
_;图中表示平衡混合物中SO3的含量最高的一段时间是
。
21.(10分)(1 )已知:在常温下,浓度均为0.1mol·L-1的下列六种溶液的pH:
)已知:在常温下,浓度均为0.1mol·L-1的下列六种溶液的pH:
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
11.3 |
依据复分解反应的规律,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3CO ONa
ONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
(2)根据前面描述的信息判断,浓度均为0.05mol·L-1的下列六种物质的溶液中,pH最小的是 (填编号);将各溶液分别稀释100倍,pH变化最小的是 (填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)根据前述信息,写出将过量的氯气通入到少量的碳酸钠溶液中反应的离子 方程式:
。
方程式:
。
(4)标准状况下,向1L含NaOH、Ca(OH)2各0.1 mol的溶液中不断通入CO2至过量,请画出产生的沉淀的物质的量(mol)随CO2通入体积(L)的变化趋势图。

20.(10分)由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2 +、Cu2+、Ba2+、C1-、SO42-、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
+、Cu2+、Ba2+、C1-、SO42-、CO32-。将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
|
实验序号 |
实验内容 |
实验结果 |
|
a |
加AgNO3溶液 |
有白色沉淀生成 |
|
b |
加足量NaOH溶液并加热 |
收集到气体1.12L(已折算成标准 状况下的体积) |
|
c |
加足量BaC 12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 |
第一次称量读数为6. 27g,第二次 称量读数为2.33g |
试 回答下列问题:
回答下列问题:
(1)该混合物中一定不存在的离子是 。
(2)试写出实验b发生反应的离子方程式 。
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
|
阴离子符号 |
物质的量浓度(mol·L-1) |
|
|
|
|
|
|
|
|
|
(4)判断混合物中是否存在K+并说明理由? 。
19.(8分)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)整个过程中充当还原剂的是 。
(2)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果计量数是1,不用填写):
(3)把KI换成KBr,则CCl4层变为 色;继续滴加氯水,CCl4层的颜色没有变化。 Cl2 、HIO3、HBrO3氧化性由强到弱的顺序是 。
18.用含1 mol HCl的盐酸酸化含1 mol MgSO4的溶液,当向其中滴加1 mol/L 的Ba(OH)2 溶 液时,产生沉淀的物质的量(n)与加入Ba(OH)2
溶液体积(V)间的关系图正确的是
液时,产生沉淀的物质的量(n)与加入Ba(OH)2
溶液体积(V)间的关系图正确的是
17.食品香精菠萝酯的生产路线(反应条件略去)如下:
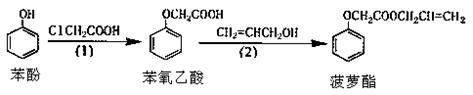
下列叙述错误的是
A.步骤⑴产物中残留的苯酚可用FeCl3溶液检验
B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
C.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
D.步骤⑵产物中残留的烯丙醇可用溴水检验
16.某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是
A.若溶液中c(A-) = c(Na+),则溶液一定呈中性
B.溶液中不可能存在:c(Na+)>c (A-)>c(OH-)>c(H+)
C.若c(OH-)>c(H+),溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+)
D.若溶质为NaA、HA,则一定存在: c(A-)>c(Na+)>c(H+)>c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com