
题目列表(包括答案和解析)
3. 下列叙述中正确的是
A. 向含有CaCO3沉淀的水中通入CO2 至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B. 向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2.
C. 等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D. 向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出
2. 下列关于溶液和胶体的叙述,正确的是
A.溶液是电中性的,胶体是带电的
B.通电时溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
1.下列物质中既有氧化性又有还原性的是
A.HClO B.Al2O3 C.N2O5 D.SiO2
30.(12分)分别取40mL的0.50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
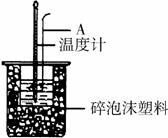 (1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式
;
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式
;
(2)如右图所示,仪器A的名称是_______________;在实验过程中,
如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H (填“偏大”、“偏小”或“无影响”);
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液
的比热容c=4. 18J/(g·℃)。为了计算中和热,某学生实验记录
数据如下:
|
实验序号 |
起始温度t1℃ |
终止温度t2℃ |
|
|
盐酸 |
氢氧化钠 |
混合溶液 |
|
|
1 |
20.0 |
20.1 |
23.2 |
|
2 |
20.2 |
20.4 |
23.4 |
|
3 |
20.5 |
20.6 |
23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H=____________________;(结果保留一位小数)
(4) (填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是 。
29. (10分) 和浓盐酸在一定温度下反应生成黄绿色的易燃物二氧化氯.其变化可表述为:
和浓盐酸在一定温度下反应生成黄绿色的易燃物二氧化氯.其变化可表述为:
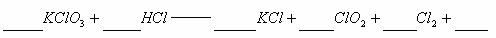
(1)完成该化学方程式并配平(未知物化学式和化学计量数填在划线上).
(2)浓盐酸在反应中显示出来的性质是_____________________________(填写编号,多选倒扣).
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1mol  ,则转移的电子的物质的量为_____________mol.
,则转移的电子的物质的量为_____________mol.
(4) 具有很强的氧化性.因此,常被用做消毒剂,其消毒的效果(用单位质量得到的电子表示)是使用
具有很强的氧化性.因此,常被用做消毒剂,其消毒的效果(用单位质量得到的电子表示)是使用 消毒效果的________________倍.
消毒效果的________________倍.
28. (18分)现有A、B、C、D、E五种盐溶液,分别由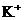 、
、 、
、 、
、 、
、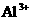 、
、 、
、 、
、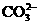 、
、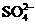 、
、 中的阳离子和阴离子各一种组成(五种盐所含阴、阳离子各不相同).已知:①A+B→白↓ ②A+D→白↓ ③B+C→白↓ ④D+C→白↓ ⑤A溶液中
中的阳离子和阴离子各一种组成(五种盐所含阴、阳离子各不相同).已知:①A+B→白↓ ②A+D→白↓ ③B+C→白↓ ④D+C→白↓ ⑤A溶液中 ⑥B溶液中
⑥B溶液中 ⑦C、D、E三种溶液的pH<7,根据以上实验事实可以推出(用分子式表示)A为___________________;B为__________________;C为___________________;D为__________________;E为___________________.
⑦C、D、E三种溶液的pH<7,根据以上实验事实可以推出(用分子式表示)A为___________________;B为__________________;C为___________________;D为__________________;E为___________________.
写出以上各步反应的离子方程式:
①_________________________________________________________________________
②_________________________________________________________________________
③_________________________________________________________________________
④_________________________________________________________________________
27.(8分)在含有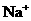 、
、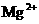 、
、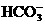 、
、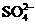 的稀溶液中,各离子的物质的量之比为:n(Na+)
: n (Mg2+ ) : n(HCO3--) : n(SO42--)=2:1:2:1
的稀溶液中,各离子的物质的量之比为:n(Na+)
: n (Mg2+ ) : n(HCO3--) : n(SO42--)=2:1:2:1
(1)向该溶液中滴加酚酞试液数滴,溶液呈________色.有关反应的离子方程式为:___________________________.
(2)充分加热(1)步所得的溶液,加热的过程中观察到的现象有_________________;
完全反应后,溶液呈_________________色,有关反应的离子方程式为:_________________.
13. 标准状况下将纯净的CH41L在空气中完全燃烧,生成CO2气和液态水,放出39.75kJ热量,则CH4燃烧的热化方程式为 ( )
A.CH4(g)+2O2(g)→CO2(g)+2H2O(l);△H=-39.75kJ/mol
B.CH4(g)+2O2(g)→CO2(g)+2H2O(l);△H=890.4kJ/mol
C.CH4(g)+2O2(g)→CO2(g)+2H2O(l);△H=-890.4kJ/mol
D.CH4(g)+2O2(g)→CO2(g)+2H2O(l);△H=39.75kJ/mol
12.下列说法或表示方法正确的是( )
A.需要加热发生的反应是吸热反应
B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H = –57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
C.由C(石墨)→C(金刚石);△H = +73 kJ/mol,可知金刚石比石墨稳定
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H = +285.8kJ/mol
11、根据下面三个化学方程式:I2+SO2+2H2O=H2SO4+2HI 2FeCl2+Cl2 = 2FeCl3
2FeCl3+2HI= 2FeCl2+2HCl+I2 有关物质的还原性强弱的顺序是( )
(A)I->Fe2+>Cl->SO2 (B)Cl->Fe2+>SO2>I- (C)Fe2+>I->Cl->SO2 (D)SO2> I->Fe2+>Cl-[来源:高&考%资(源#网]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com