
题目列表(包括答案和解析)
10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②b中反应所产生的I2的物质的量是 mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
_________________mg/kg。
哈尔滨市第三中学2011届九月月考
24.(12分)哈尔滨市场销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
20-50 mg/kg |
|
分装日期 |
|
|
分装企业 |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
___KIO3+___KI+___H2SO4 =___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及上述步骤中的位置是_________________________________。
(3)已知:I2+2S2O32 - = 2I-+S4O62 -。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液
23.(12分)中学化学常见的物质A、B、C、D之间存在如下转化关系:
A + B → C + D + H2O。请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体。C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式
是 ,
鉴别这两种气体不能选用的试剂是 。
a.BaCl2溶液 b.KMnO4溶液 c.品红溶液 d.酸化的Ba(NO3)2溶液
向500mL 2mol/L的NaOH 溶液中通入0.8mol无色无味的C气体,恰好完全反应,该反应的总化学方程式是 ,此时溶液中的离子按照浓度由大到小排列的顺序是 。
(2)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;D是漂白粉的成分之一。C发生水解反应的离子方程式是 。
(3)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体。检验A中阴离子的方法是
(简述操作过程及结论)。
22.(15分)X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)。
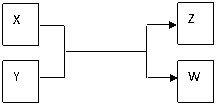
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是 。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途 。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是 。
Ⅱ.下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
①一般认为H2SO4浓度大于60%,就具有一定的强氧化性,越浓氧化性越强,60%以下的H2SO4主要体现的是酸性,基本上不体现强氧化性。
②温度也影响氧化性,如铜放于冷的浓H2SO4中反应不明显,如果加热就可以观察到明显现象。
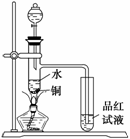 ③98%的浓H2SO4物质的量浓度为18.4 mol/L,密度为1.84
g·cm-3,根据以上信息回答:
③98%的浓H2SO4物质的量浓度为18.4 mol/L,密度为1.84
g·cm-3,根据以上信息回答:
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3 mL水,然后从分液漏斗中加98%的浓H2SO4 0.5 mL,加热至沸腾,该试管中液体没有明显变化,试用数据解释
原因 。
(2)乙同学利用所示装置直接从分液漏斗中再加浓H2SO4 10 mL与铜片反应。在左边试管中所观察到与甲不同的现象除了有黑色物质出现外,还有
① ,
原因是 。
② ,
原因是 。
21.(11分)用Cl2消毒会使饮用水中的有机物发生氯化,生成有机氯化合物,于人体有害。世界环保联盟即将全面禁止用氯气对饮用水消毒。建议推广采用广谱性高效消毒剂ClO2气体。
(1)目前,欧洲一些国家用NaClO3氧化浓盐酸制取ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半,该反应的化学方程式是: 。
(2)我国最近研究成功用氯气氧化亚氯酸钠(NaClO2,N2保护下)制ClO2,其反应的化学方程式为: ,
这一反应的优点是: 。
(3)在H2SO4存在的条件下,用Na2SO3还原NaClO3也可制ClO2,其反应的化学方程式为:
。
28.A、B、C、D、G都是含有同一种短周期元素的化合物,E是氧化物,H是单质。根据下图转化关系(反应条件及部分产物已略去)填空:
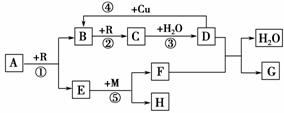
(1) 若A、B、C、D、G均含X元素,且A的分子中只含有10个电子,G是复合
肥料,则反应①、②、③是工业生产________的基本原理,M的化学式为________;
其中反应①的化学方程式为______________________________________________;
反应④的离子方程式为__________________________________________________。
(2) 若A、B、C、D、G均含Y元素,Y元素处于X的相邻周期、相邻主族,G可
作净水剂,则反应①、②、③均是工业生产________的基本原理,M形成的晶体
类型为________;其中反应①的化学方程式_________________________________;
反应⑤的化学方程式为_________________________________________________。
27.已知:
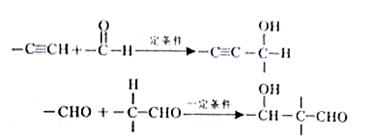
以乙炔为原料,通过下图所示步骤能合成有机中间体E(转化过程中的反应条件及部分产物已略去)。

其中,A,B,C,D分别代表一种有机物,B的化学式为C4H10O2,分子中无甲基。
请回答下列问题:
(1) A生成B的化学反应类型是____________________________。
(2) 写出生成A的化学反应方程式____________________________________。
(3) B在浓硫酸催化下加热,可生成多种有机产物。写出2种相对分子质量比A小的有机产物的结构简式:_________________、__________________。
(4) 写出C生成D的化学反应方程式:
______________________________________________________________。
(5)含有苯环,且与E互为同分异构体的酯有______种,写出其中一种同分异构体的结构简式__________________________________________________________。
26.有一无色透明溶液,欲确定是否含有下列离子: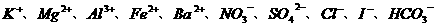 ,取该溶液实验如下:
,取该溶液实验如下:
|
实验步骤 |
实验现象 |
|
(1)取少量该溶液,加几滴甲基橙 |
溶液变红色 |
(2)取少量该溶液加热浓缩,加Cu片和浓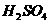 ,加热 ,加热 |
有红棕色气体产生 |
(3)取少量该溶液,加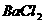 溶液 溶液 |
有白色沉淀生成 |
(4)取(3)中上层清液,加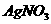 溶液 溶液 |
有白色沉淀生成,且不溶于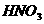 |
|
(5)取少量该溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定存在的离子是__________________,溶液中肯定不存在的离子是_______________________。
(2)还应进一步检验的离子名称及应该补充的实验(如为溶液反应,说明使用试剂的名称。不必写详细操作步骤)_____________________________________________________________________________________________________________________________________________。
25.已知甲烷和一氧化碳的混合气体共0.75 mol,完全燃烧后,生成二氧化碳气体和18 g液态水,并放出515 kJ的热量。若甲烷燃烧的热化学方程式为CH4(g)+2O2(g)====CO2(g)+2H2O(l);ΔH=-890 kJ·mol-1,则表示CO气体燃烧热的热化学方程式为________________________________。
24.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg / L。现用氯氧化法处理,发生如下反应(其中N均为-3价): KCN + 2KOH + Cl2 → KOCN + 2KCl + H2O
被氧化的元素是 。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并用单线桥法标出电子转移方向和数目:

 KOCN+ KOH+ Cl2 CO2 + N2 + KCl + H2O
KOCN+ KOH+ Cl2 CO2 + N2 + KCl + H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com