
题目列表(包括答案和解析)
18.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3 C 高温 2 AlN + 3 CO 下列叙述正确的是( )
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为 -3
D.氮化铝晶体属于分子晶体
17.不能用胶体知识解释的是
A.牛油与NaOH溶液共煮,向反应后所得的溶液中加入食盐,会有固体析出
B.一支钢笔用不同牌子的两种墨水,易堵塞
C.氯化铁溶液加入碳酸钠溶液出现红褐色沉淀
D.河水和海水交界处形成三角洲
16.下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.工业电解氧化铝制铝时用铁作阳极
C.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室
15.已知H2(g)+ I2(g) 2HI(g);ΔH<0。有相同容积的定容密封容器甲和乙,甲中加入
2HI(g);ΔH<0。有相同容积的定容密封容器甲和乙,甲中加入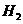 和
和 各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
A.甲、乙提高相同温度 B 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D 甲增加0.1mol 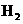 ,乙增加0.1mol
,乙增加0.1mol 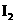
14.下列反应的离子方程式正确的是
A.少量SO2通入氨水中反应:SO2+NH3·H2O=NH4++HSO3-
B.以石墨作电极电解氯化铝溶液:2Cl-+2H2O  2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.氯化铝溶液中加入过量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O
D.向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3·H2O+ H2O
13.下列关于电解质溶液的叙述正确的是 ( )
A. 同浓度同体积的NaClO溶液和CH3COONa溶液,离子总数前者大于后者
B. 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C. 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D. 已知0.1mol·L-1的H2A溶液,其pH>1;
则0.1mol·L-1的NaHA溶液,其pH=5,溶液中c(HA-)>c(H+)>c(A2-)>c(H2A)
12.下列各组离子,在溶液中能大量共存、加入足量NaOH溶液后加热既有气体放出又有沉淀生成的一组是
A.Ba2+ 、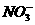 、
、 、
、 B.
B.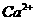 、
、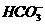 、
、 、Al3+
、Al3+
C.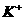 、Ba2+、
、Ba2+、 、
、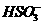 D.Ba2+ 、
D.Ba2+ 、 、
、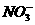 、
、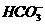
11.体育竞技中服用兴奋剂既有失公平,也败坏了体育道德。某种兴奋剂的结构简式如图所示。有关该物质的说法中正确的是
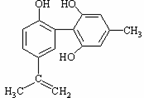 A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol
D.该分子中的所有碳原子不可能共平面
10.
 含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
 A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
 B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
 C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
 D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
9.
 已知:CO2(少量)+3H2O+2AlO2-=2Al(OH)3↓+CO32-。
已知:CO2(少量)+3H2O+2AlO2-=2Al(OH)3↓+CO32-。
现有等温、等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠,⑦偏铝酸钠。按溶液pH由小到大排列正确的是
 A.④①②⑤⑥⑦③
B.④①②⑥⑤③⑦
A.④①②⑤⑥⑦③
B.④①②⑥⑤③⑦
 C.①④②⑥③⑤⑦
D.①④②③⑥⑦⑤
C.①④②⑥③⑤⑦
D.①④②③⑥⑦⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com